 |
Часть 3. Биохимия межклеточного матрикса
|
|
|
|
У многоклеточных организмов клетки окружены внеклеточным матриксом, который представляет собой сложный комплекс макромолекул: белков и гетерополисахаридов. Эти макромолекулы секретируются самими клетками, а в матриксе они образуют упорядоченную сеть. Внеклеточный матрикс влияет на прикрепление клеток, их организацию, развитие и метаболизм. Он образует высокоспециализированные структуры: хрящ, сухожилия, базальную мембрану, кости, зубы. Функции матрикса заключаются также в образовании каркаса органов и тканей, участии в регуляции водно-солевого обмена. Кроме этого, внеклеточный матрикс является универсальным «биологическим» клеем. Основные классы макромолекул, образующих матрикс, это: 1) структурные белки коллаген и эластин и 2) гетерополисахариды из группы гликозаминогликанов, связанных с белком в комплексы - протеогликаны. Гликозаминогликаны и протеогликаны образуют гидратированный гель, в который погружены коллагеновые и эластиновые волокна. Коллагеновые волокна укрепляют и упорядочивают матрикс, эластин придает матриксу упругость, полисахаридный гель обеспечивает перенос питательных веществ, метаболитов между кровью и клетками тканей.
Внеклеточный матрикс с находящимися в нем клетками (фибробластами, макрофагами, тучными клетками) называют соединительной тканью. Количество соединительной ткани в различных органах широко варьирует, т. е. количество различных макромолекул и способы их организации разнообразны и отвечают функциональным требованиям конкретной ткани.
Глава 3.1. Коллаген
Одним из главных компонентов соединительной ткани являются коллагеновые волокна, входящие в состав кожи, сухожилий, костей, хрящей, кровеносных сосудов, базальных мембран, роговиц глаза. Коллаген - основной структурный белок внеклеточного матрикса. Под «коллагеном» понимается множество близкородственных фибриллярных белков. В разных тканях преобладают разные типы коллагена в зависимости от функциональной роли, которую этот белок выполняет в конкретной ткани.
|
|
|
В настоящее время известно 19 типов коллагена, отличающихся по аминокислотной последовательности, функциям и локализации в организме. Молекулы коллагена образуют полимеры, называемые фибриллами коллагена и обладающие огромной прочностью (прочнее стальной проволоки того же сечения). Фибриллы коллагена практически нерастяжимы. Механические свойства коллагенов объясняются их первичной и пространственной структурой.
Молекула коллагена состоит из трех полипептидных цепей (a-цепей), содержащих до 1000 аминокислотных остатков. Тип коллагена записывается римской цифрой в скобках, для обозначения a-цепей используют арабские цифры. Например, коллаген I типа, являющийся гетеротримером, содержащим два разных типа a-цепей, имеет структуру [a1(I)]2a2(I). Индекс за скобкой обозначает количество идентичных a-цепей.
Каждый третий аминокислотный остаток в полипептидной цепи представлен глицином, каждая четвертая аминокислота в полипептидной цепи является пролином или 4-гидроксипролином. В коллагене отсутствуют цистеин, триптофан, очень мало гистидина, глутамина, метионина, фенилаланина, тирозина. Кроме этого, присутствует необычная аминокислота - гидроксилизин.
Первичную последовательность коллагена схематично можно записать как (Gly-X-Y)n, где X чаще всего представлен пролином, а в положении Y стоит или гидроксипролин, или гидроксилизин. Все это имеет большое значение для формирования фибрилл коллагена. Глицин - самая маленькая из аминокислот и единственная, которая способна поместиться внутри тесной тройной спирали, причем это не a-спираль, как у большинства глобулярных белков, а спираль 310, т. е. на виток спирали приходится три аминокислотных остатка. Пролин, задающий жесткость структуре, располагается в изгибах полипептидной цепи, стабилизируя левозакрученную конформацию спирали силами стерического отталкивания своих пирролидиновых колец. Это приводит к увеличению расстояния между аминокислотными остатками по оси спирали, которые становятся больше, чем в a-спирали глобулярных белков, и спираль получается более развернутой.
|
|
|
Три левые спирали закручиваются в правую суперспираль. Правозакрученная трехцепочечная суперспиральная молекула называется тропоколлагеном. Глицин находится в местах пересечения цепей, и отсутствие у него бокового радикала позволяет этим цепям плотно прилегать друг к другу. Пролин и гидроксипролин ограничивают вращение полипептидных цепей и увеличивают стабильность тройной спирали, которая поддерживается также водородными связями, возникающими между амино- и карбоксильными группами боковых радикалов пептидного остова молекулы тропоколлагена.
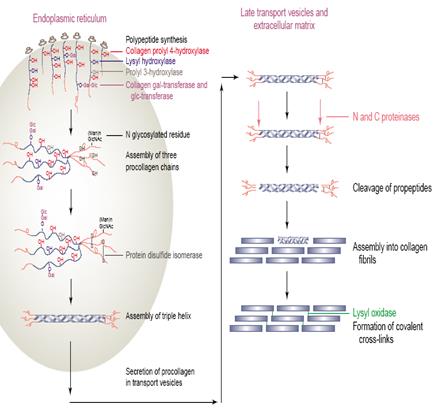
Рис. 3.1. Основные этапы синтеза коллагена (согласно [14])
Боковые радикалы из триады аминокислот Gly-X-Y располагаются на наружней поверхности молекулы тропоколлагена и могут взаимодействовать с боковыми группами других молекул тропоколлагена с образованием ионных, водородных и гидрофобных связей, формируя коллагеновые фибриллы, в которых одна нить тропоколлагена сдвинута относительно другой на 1/4. Между концом одной молекулы тропоколлагена и началом другой в фибрилле есть пространство, где может кристаллизоваться гидроксиапатит при образовании кости. Таким образом, аминокислотная последовательность коллагенов позволяет сформировать уникальную по своим механическим свойствам структуру, обладающую большой прочностью.

Рис. 3.2. Тройная спираль проколлагена (согласно [10])
Коллаген хотя и внеклеточный белок, но синтезируется в клетке на полирибосомах в виде длинного предшественника - препро-a-цепей, подвергающихся далее посттрансляционной модификации. Основные этапы синтеза коллагена приведены на рис. 3.1. При прохождении через эндоплазматический ретикулум и комплекс Гольджи предшественник коллагена (препроколлаген) претерпевает процессинг. Процессинг начинается с отщепления сигнальной последовательности из примерно ста аминокислотных остатков на N-конце препроколлагена (основная функция этой последовательности - ориентация синтеза полипептидных цепей в полость эндоплазматического ретикулума). Далее пролиновые и лизиновые остатки в проколлагене в Y-положении подвергаются гидроксилированию с помощью пролил-4-гидроксилазы и лизил-5-гидроксилазы, а пролин в положении Х иногда гидроксилируется пролил-3-гидроксилазой. Гликозилтрансфераза переносит остатки глюкозы или галактозы на остатки гидроксилизина. Гидроксилированный пролин, в отличие от простого пролина, образует межцепочечные водородные связи, также участвующие в стабилизации тройной спирали. В условиях, препятствующих гидроксилированию пролина (недостаток кислорода, железа или аскорбиновой кислоты), спирали проколлагена не образуются. При цинге, возникающей из-за недостатка витамина С в
|
|
|

Рис. 3.3. Отщепление N- и С-пропептидов и форимирование коллагеновых фибрилл (согласно [9])
пище, негидроксилированные про-a-цепи гидролизуются, что ведет к хрупкости кровеносных сосудов и кожи. На N- и С-концах молекулы проколлагена содержатся пропептиды молекулярной массы 20 000 и 30 000-35 000, формирующие глобулярные домены. В составе этих пептидов есть остатки Cys. N-концевой пропептид образует только внутрицепочечные дисульфидные мостики, а в С-концевом пропептиде есть как внутри- так и межцепочечные дисульфидные связи (рис. 3.2). Предполагается, что пропептиды нужны для правильного образования тройной спирали, так как про-a-цепи спонтанно объединяются в тройные спирали in vitro, тогда как a-цепи уже не обладают подобным свойством. Концевые пептиды, возможно, играют также важную роль в упаковке молекул проколлагена перед выведением его из клетки. После образования дисульфидных связей молекулы проколлагена собираются в тройную спираль (см. рис. 3.1), после формирования которой гидроксилирование остатков пролина и лизина и гликозилирование гидроксилизина становятся невозможными. Внутриклеточный процессинг завершается продвижением тройной спирали к наружней поверхности клеток, где в комплексе Гольджи проколлаген включается в секреторные пузырьки и секретируется в межклеточное пространство. Внеклеточные аминопротеаза и карбоксипротеаза проколлагена удаляют пропептиды с N- и С-конца соответственно с образованием тропоколлагена (рис. 3.3). Молекулы тропоколлагена спонтанно собираются в фибриллы. При снижении активности протеаз пропептиды не отщепляются, нарушается образование тропоколлагена и коллагеновых фибрилл, что приводит к малому росту, искривлению позвоночника, высокой растяжимости кожи. В некоторых коллагенах (типов IV, VIII, X) пропептиды не отщепляются, а способствуют образованию сетчатой структуры.
|
|
|
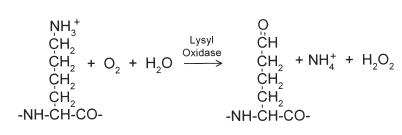
лизин аллизин
Рис. 3.4. Схема реакции окисления лизина в аллизин, катализируемой лизилоксидазой
Внеклеточный фермент лизилоксидаза, содержащий ион Cu2+, пиридоксальфосфат и NADН, катализирует окислительное дезаминирование e-аминогрупп некоторых остатков лизина и гидроксилизина коллагена с образованием альдегидов - аллизина и гидроксиаллизина соответственно (рис. 3.4), вступающих в реакцию Шиффа с другими остатками лизина, гидроксилизина или гликозилированного гидроксилизина с образованием дегидролизиннорлейцина, дегидрогидроксилизиннорлейцина (рис. 3.5). Шиффовы основания, синте-
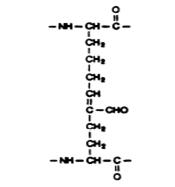
дегидро-(гидрокси)- продукт альдольной
лизиннорлейцин конденсации (ПАК)
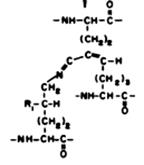
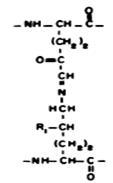
дегидро(гидрокси) продукт перегруппировки
меродесмозин Амадори
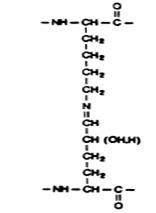
Рис. 3.5. Продукты сшивок в коллагене
зированные в результате этих реакций, могут подвергаться химической перегруппировке (перегруппировке Амадори), образуя стабильные (кетоаминные) ковалентные сшивки, при этом гидроксиаллизин формирует более стабильную связь, чем аллизин. Перекрестная сшивка молекул обеспечивается также альдольной конденсацией. Продукт альдольной конденсации, взаимодействуя с лизином или гидроксилизином, образует продукты тройной сшивки - дегидромеродесмозин или дегидрогидроксимеродесмозин. Продукты сшивок альдегидных производных с аминопроизводными могут быть восстановлены NADН с образованием производных вторичных аминов, более стабильных, чем основания Шиффа (рис. 3.6). Таким образом, возникающие поперечные сшивки стабилизируют фибриллы коллагена. Количество сшивок зависит от функции и возраста ткани и возрастает со временем, что приводит к замедлению обмена коллагена у пожилых людей. При недостатке ионов меди, витаминов РР и В6 нарушается образование поперечных сшивок и снижается прочность и упругость коллагеновых волокон.
|
|
|
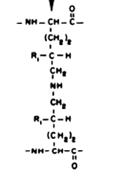 Рис. 3.6. Продукт восстановительной сшивки в коллагене (лизиннорлейцин)
Рис. 3.6. Продукт восстановительной сшивки в коллагене (лизиннорлейцин)
Ферменты, участвующие в модификации коллагена, представляют особый интерес из-за разнообразия структур и функций коллагена, изменения которых вызывают многочисленные нарушения в организме, приводящие к заболеваниям. Эти ферменты - пролил- и лизилгидроксилазы, гликозилтрансферазы, лизилоксидаза.
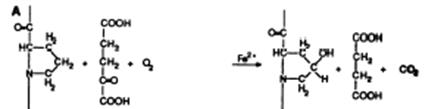
пролин a-кетоглутарат 4-гидроксипролин сукцинат
Рис. 3.7. Схема реакции гидроксилирования пролина, катализируемой пролилгидроксилазой
Лизил- и пролилгидроксилазы, связанные с мембранами микросом оксигеназы, катализируют похожие реакции гидроксилирования аминокислоты (лизина или пролина), сопряженные с окислительным декарбоксилированием a-кетоглутарата в присутствии иона Fe2+ и витамина С, аскорбиновой кислоты (рис. 3.7). Лизилгидроксилаза является гомодимером структуры a2, пролилгидроксилаза - гетеротетрамер структуры a2b2. b-Субъединиц синтезируется больше, чем a-субъединиц, но отдельные субъединицы не проявляют гидроксилазной активности, так как активный центр формируется на поверхности контакта субъединиц. Известно, что b-субъединица пролилгидроксилазы обладает также дисульфидизомеразной активностью, может присутствовать в эндоплазматическом ретикулуме и в виде мономера, и в комплексе с другими белками.
А Б
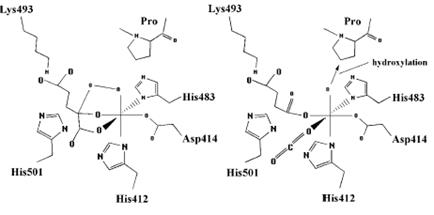
Рис. 3.8. Механизм реакции гидроксилирования, катализируемой пролилгидроксилазой: А - в координационной сфере иона Fe2+ находятся остатки His412, His483, Asp414, атомы кислорода карбонильной и карбоксильной групп a-кетоглутарата, один из атомов молекулы кислорода. Второй кислородный атом атакует a-углеродный атом a-кетоглутарата, происходит отщепление СО2 (декарбоксилирование) и образование сукцината; Б - атом кислорода, находящийся в координационной связи с ионом Fe2+, атакует атом углерода в четвертом положении пролина (согласно [13])
Этот фермент, катализируя изомеризацию дисульфидных связей, выступает в роли шаперона и помогает вновь синтезированным белкам принять нативную конформацию, необходимую для проявления их свойств. На рис. 3.8 рассмотрен механизм реакции гидроксилирования пролина с помощью пролилгидроксилазы. На первом этапе реакции ион Fe2+ образует координационные связи с двумя остатками гистидина, остатком аспартата, кислородными атомами карбоксильной и карбонильной групп a-кетоглутарата и одним из атомов молекулы кислорода. Нуклеофильная атака a-углеродного атома a-кетоглутарата вторым атомом молекулы кислорода приводит к отщеплению СО2, образованию сукцината, разрыву связи в молекуле кислорода (см. рис. 3.8, А). На втором этапе происходит атака атомом кислорода, координированным ионом Fe2+, четвертого углеродного атома пролина с образованием 4-гидроксипролина (см. рис. 3.8, Б).
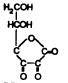
При реакции гидроксилирования ион Fe2+ окисляется до состояния +3. Для восстановления ферроформы необходим биологический восстановитель. В данном случае эта роль отводится аскорбиновой кислоте, которая легко окисляется в дегидроаскорбиновую:

 .
.
Уже упоминалось, что недостаток аскорбиновой кислоты в пище приводит к хрупкости кровеносных сосудов и истонченности кожи. Восстановление дегидроаскорбиновой кислоты происходит в ферментативном процессе за счет глутатиона (g-глутамилцистеинилгли- цина, или GSH), превращающегося в окисленный глутатион, содержащий две молекулы глутатиона, связанные дисульфидной связью (GSSG).
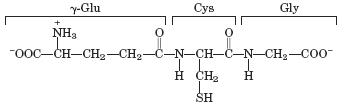
глутатион (GSH)
Механизм реакции гидроксилирования лизина подобен механизму реакции с пролином, но одна из изоформ лизилгидроксилазы обладает активностью гликозилтрансферазы, перенося на образовавшуюся гидроксильную группу остаток галактозы из UDP-галактозы, а на нее - остаток глюкозы из UDP-глюкозы. Таким образом синтезируется гликозилированный модифицированный проколлаген. Число углеводных остатков в молекуле коллагена определяется видом ткани и колеблется от нескольких единиц в коллагене сухожилий (тип I) до сотен в коллагене капсулы хрусталика (тип IV). Роль углеводных остатков в коллагене до сих пор не выяснена.
Лизилоксидаза - внеклеточный фермент - синтезируется в клетке в виде предшественника, на поверхности фибробластов активируется частичным протеолизом под действием протеиназы С проколлагена, расщепляющей связь Gly162-Asp163. Фермент относится к классу оксидоредуктаз. В качестве кофакторов содержит ион Cu2+ и лизилтирозилхинон (рис. 3.9), образующийся при окислении ионом Cu2+ определенного остатка тирозина до дигидроксифенилаланинхинона. Ковалентное присоединение к этому производному остатка лизина дает кофактор, необходимый для протекания лизилоксидазной реакции.
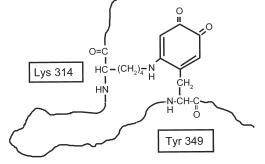
Рис. 3.9. Кофактор лизилоксидазной реакции - лизинтирозилхинон (согласно [12])
Субстратами лизилоксидазы являются белки и пептиды, изоэлектрическая точка которых лежит в щелочной области. Механизм реакции, катализируемой лизилоксидазой, представлен на рис. 3.10. Сначала e-аминогруппа остатка лизина субстрата образует основание Шиффа с одним из карбонильных атомов лизилтирозилхинона (стадия 1). Отщепление протона под действием нуклеофила В (стадия 2) с одновременной подачей двух электронов от субстрата к хинону генерирует восстановленный лизилтирозилиминохинол (ста- дия 3). Гидролиз иминопроизводного приводит к высвобождению альдегидного продукта и восстановленного кофактора (стадия 4). Окисление восстановленного кофактора кислородом воздуха происходит с образованием перекиси водорода и хинонимина (стадия 5). Хинонимин, гидролизуясь в водных условиях, регенерирует лизилтирозилхинон. 
Рис. 3.10. Механизм реакции, катализируемой лизилоксидазой: 1 - гидролиз иминохинона с регенерацией кофактора фермента - лизилтирозилхинона и образованием иона аммония; 2 - образование Шиффова основания между остатком лизина субстрата и лизилтирозилхиноном; 3 - отщепление протона под действием нуклеофила и подача двух электронов от субстрата в хиноидную структуру; 4 - отщепление в результате гидролиза альдегидного продукта и восстановленного кофактора; 5 - окисление кислородом воздуха восстановленного кофактора с генерацией перекиси водорода и иминохинона. (согласно [12])
Лизилоксидаза важна не только для создания перекрестных сшивок в коллагене и эластине, но и для репарации этих молекул внеклеточного матрикса при старении и заболеваниях. Показано, что экспрессия этого белка увеличивается в клетках некоторых опухолей, например при раке молочной железы.
Коллаген, как любой белок, подвергается в организме обмену, хотя и медленному. Разрушение коллагеновых волокон происходит под действием определенных гидролаз (коллагеназ) или активных форм кислорода. Тканевая коллагеназа, требующая для проявления своей активности иона Zn2+ и активируемая плазмином, калликреином и катепсином В, разрезает тройную цепь коллагена в определенном месте на 1/4 расстояния от С-конца между Gly-Leu (Ile). Образовавшиеся фрагменты спонтанно денатурируют и становятся доступными действию протеаз. Усиленный распад коллагена происходит при аутоиммунных заболеваниях, а нарушение катаболизма коллагена ведет к фиброзу органов и тканей. Бактериальная коллагеназа гидролизует связь Х-Gly, разрушая соединительно-тканные барьеры в организме человека, обеспечивая проникновение микроорганизмов и вызывая тяжелые заболевания, например газовую гангрену.
Регуляция синтеза коллагена осуществляется самим коллагеном и N-пропептидами по принципу отрицательной обратной связи путем торможения трансляции коллагена, а также действием гормонов. Глюкокортикоиды тормозят синтез коллагена, ингибируя пролил- и лизилгидроксилазы и повышая чувствительность к действию коллагеназы и неспецифических протеаз. Уменьшение половых гормонов (эстрогенов) также отрицательно влияет на синтез коллагена, снижая его содержание в дерме у женщин в менопаузе.
Глава 3.2. Эластин
Вторым важным белком межклеточного матрикса является эластин, содержащийся в больших количествах в коже, стенках кровеносных сосудов, связках, легких, там, где необходимы резиноподобные свойства: высокая прочность на разрыв и способность растягиваться в несколько раз в длину и сжиматься после снятия нагрузки. Эластин содержит около 800 аминокислотных остатков. В его составе много неполярных аминокислот: глицина, валина, аланина, а также пролина и валина, совсем нет гидроксилизина, немного гидроксипролина. Из-за наличия большого количества гидрофобных аминокислотных остатков эластин не может сформировать устойчивую глобулу и стабильные вторичные и третичные структуры, а принимает множество конформаций с примерно одинаковой свободной энергией. Это приводит к возникновению необходимых белковых свойств. Молекулы эластина связаны поперечными сшивками в разветвленную сеть. Для эластина характерны сшивки между двумя, тремя, четырьмя и т. д. остатками лизина и аллизина с образованием дегидролизиннорлейцина (ДЛНЛ), восстановление которого дает лизиннорлейцин (ЛНЛ), и десмозинов (рис. 3.11).

а б
Рис. 3.11. Образование поперечных сшивок в эластине: а - дегидролизиннорлейцин (ДЛНЛ), б - десмозин. Поперечные сшивки в эластине образуются путем взаимодействия одного остатка лизина и одного остатка аллизина (а) и одного остатка лизина и трех остатков аллизина (б). Гидрогенолиз ДЛНЛ приводит к генерации лизиннорлейцина (ЛНЛ) (согласно [16])
Для образования десмозина три остатка лизина окисляются лизилоксидазой в аллизин, далее два аллизина взаимодействуют, образуя продукт альдольной конденсации (ПАК), а лизин вступает в реакцию Шиффа с остатком аллизина, на следующей стадии реакции ПАК конденсируется с основанием Шиффа с образованием замещенного пиридиниевого кольца, т. е. десмозина. ПАК может вступить в реакцию и с остатком гистидина, что приведет к генерации альдольгистидина.
Свойства эластичности, т. е. способность растягиваться и сжиматься в разных направлениях, обусловлены наличием поперечных сшивок между пептидными цепями эластина с неупорядоченной, случайной конформацией. Эластин синтезируется как растворимый мономер (тропоэластин). Он приобретает свою внеклеточную нерастворимую форму после образования сшивок.
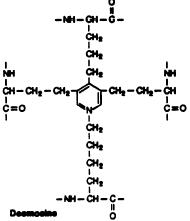
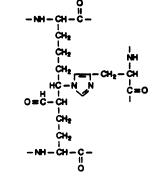
десмозин альдольгистидин.
Эластин характеризуется очень медленным обменом. При снижении образования десмозинов уменьшается количество поперечных сшивок в эластине, что приводит к уменьшению прочности на разрыв, вялости, растяжимости, истонченности и проявляется в виде частых пневмоний, аневризмов аорты, дефектов клапанов сердца. Снижение активности лизилоксидазы, дефицит меди или пиридоксина, нарушение всасывания меди также могут вызывать нарушения в структуре эластина.
Эластин медленно гидролизуется пепсином и эластазой, расщепляющей пептидные связи, образованные карбоксильными группами алифатических аминокислот. Эластаза, выделяемая во внеклеточное пространство нейтрофилами, является активной протеазой. В легочной ткани разрушение эластина приводит к потере эластичных свойств, разрушению альвеол и развитию эмфиземы легких. В норме эластаза нейтрофилов ингибируется a1-антитрипсином, синтезируемым в печени и альвеолярными макрофагами, защищающими легкие от действия эластазы. При недостатке антитрипсина повышается риск развития эмфиземы легких.
|
|
|


