 |
Методы ингаляционного наркоза
|
|
|
|
Масочный наркоз
Масочный наркоз применяется главным образом при операциях пациентов, не страдающих выраженными нарушениями дыхания и сердечной деятельности, а также функции паренхиматозных органов.Его можно применять тогда, когда нет необходимости обеспечивать миорелаксацию и приводить тело пациента в положение на операционном столе, затрудняющее вентиляцию легких.
Для проведения масочного наркоза используют специальные наркозно-дыхательные аппараты.Перед наркозом всю систему аппарата несколько раз продувают кислородом.Пациент дышит через маску вначале чистым кислородом (привыкает к маске), а затем анестетиком в минимальной концентрации. Если масочный наркоз применяется для обезболивания малотравматичных операций - достаточно поддерживать глубину наркоза на 1 уровне хирургической стадии, если операция травматична и требуется релаксация - необходимо углубить наркоз до 2 уровня хирургической стадии.
После достижения второго уровня хирургической стадии (при использовании галогана он достигается за 5—7 мин наркоза) в маску можно ввести воздухопровод и зафиксировать ее лямками (рис. 23). Если воздухопровод не используется, следует, удерживая нижнюю челюсть руками, вывести ее вперед для предотвращения западания языка и отвисания нижней челюсти, которые могут вызвать частичное закрытие верхних дыхательных путей. Внешний конец воздухопровода крепится к углу рта клейким пластырем или фиксируется лямками вокруг шеи пациента. После закрепления воздухопровода на лицо пациента накладывается маска. Такая последовательность действий облегчает проведение вспомогательной вентиляции легких.
|
|
|

Масочному методу обезболивания присущи определенные недостатки, затрудняющие его применение при продолжительных и травматичных хирургических вмешательствах:
1)наличие большого мертвого пространства между маской и лицом пациента;
2) сложность обеспечения при поверхностном наркозе проходимости дыхательных путей из-за возможных спазмов голосовых связок; при глубоком наркозе западания языка, аспирации слизи и крови;
3) необходимость углубления наркоза до второго уровня хирургической стадии (поскольку миорелаксация при поверхностном уровне не достигается), что сопровождается угнетением жизненных функций организма;
4) сложность обеспечения вспомогательной и особенно искусственной вентиляции легких, так как при масочном наркозе воздух может раздувать желудок и тем самым способствовать возникновению регургитации;
5) невозможность проведения обезболивания при многих отоларингологических, офтальмологических и нейрохирургических операциях, так как манипуляции анестезиолога над маской могут затруднять действия хирурга.
Ингаляционный наркоз также можно проводить через ларингеальную маску и через эндотрахеальную трубку.
Эндотрахеальный наркоз
В современных условиях обезболивание большинства оперативных вмешательств осуществляется под эндотрахеальным (интубационным) наркозом.
Эндотрахеальный наркоз по сравнению с масочным имеет ряд преимуществ: 1) не нарушает проходимости верхних дыхательных путей; 2) создает оптимальные условия для проведения искусственной вентиляции легких при любом положении пациента (сидя, лежа на животе, литотомическом, Тренделенбурга и т. п.); 3) позволяет широко использовать миорелаксанты и достигать хорошего расслабления мышц при поверхностном наркозе с минимальным токсическим действием анестетика на организм; 4) обеспечивает уменьшение мертвого пространства в дыхательной системе наркозного аппарата; 5) обеспечивает благоприятные условия для непрерывного отсасывания из трахеи и бронхов слизи, гноя, крови, детрита, рвотных масс; 6) позволяет исключить из вентиляции отдельные участки легких при сохранении ее в остальных отделах (применение раздельной интубации бронхов, бронхоблокаторов); 7) позволяет выполнять оперативные вмешательства в области головы и шеи.
|
|
|
Вместе с тем эндотрахеальному наркозу присущи некоторые недостатки, не характерные для других методов анестезии: 1) определенная сложность методики, требующая использования специального оборудования и соответствующей подготовки персонала; 2) раздражающее действие эндотрахеальной трубки на слизистую оболочку трахеи; 3) вероятность распространения инфекции из верхних отделов дыхательных путей в нижние.
Показания к применению эндотрахеального наркоза: при оперативных вмешательствах на органах грудной клетки, продолжительных (свыше 1 ч) и травматичных операциях на органах брюшной полости, нейрохирургических вмешательствах, при операциях, сопровождающихся большой кровопотерей, и в случаях, когда необходима хорошая миорелаксация. Показанием к этому виду обезболивания является оперативное вмешательство при таком положении пациента на операционном столе, при котором нарушается биомеханизм дыхания и возникает необходимость в применении искусственной вентиляции легких (положение Тренделенбурга, на животе, литотомическое и др.).
Относительные противопоказания: острые инфекционно-воспалительные заболевания верхних дыхательных путей (трахеит, ларингит, фарингит, ринит и др.). Его применение также ограничивается в тех случаях, когда могут возникнуть значительные затруднения при интубации трахеи (анкилоз височно-нижнечелюстного сустава, сужение гортани или трахеи и другие заболевания этих органов).
Методика эндотрахеального наркоза. Перед введением в наркоз пациенту необходимо провести ингаляцию кислорода в течение 5—6 мин через маску наркозного аппарата с полуоткрытым контуром. Введение в наркоз осуществляется с помощью ингаляционных или неингаляционных анестетиков. После отключения пациента сознания и исчезновения пальпебральных рефлексов ему вводятся миорелаксанты для интубации трахеи (суксаметония хлорид — 1,5—2 мг/кг, рокурония бромид — 0,6 мг/кг). После миорелаксации и исключения спонтанного дыхания проводится интубация трахеи. Введение в наркоз анестетиками, вводящимся внутривенно, осуществляется в процессе непрерывной ингаляции кислорода пациенту.
|
|
|
Методика интубации трахеи. Интубация трахеи, как правило, осуществляется под визуальным контролем с помощью ларингоскопа через рот (оротрахеальная) или через нос (назотрахеальная). Для облегчения интубации большое значение имеет правильное положение головы и шеи пациента. Используются два положения. Первое — классическое положение Джексона (рис. 25, а), при котором затылочная область головы лежит на плоскости стола, голова откинута назад, подбородок поднят кверху и нижняя челюсть выведена вперед. При этом оси гортани и трахеи, а также край верхних резцов образуют почти прямую линию. Недостатки этой методики интубации — напряжение мышц шеи и увеличение расстояния от зубов до голосовой щели. Эти недостатки можно устранить, если применить положение, названное Джексоном «улучшенным» (рис. 25, б). При этом голова пациента лежит на подушке высотой 10—12 см и слегка откинута назад. Оси гортани и глотки почти совпадают, ось ротовой полости находится под тупым углом к осям гортани и глотки. Если при этом вывести нижнюю челюсть вперед, все три оси образуют почти прямую линию. Улучшенное положение Джексона облегчает интубацию и позволяет предотвратить травмирование слизистой оболочки гортани. Начинающие анестезиологи нередко стараются максимально запрокинуть голову пациента назад (рис. 25, в), что затрудняет интубацию.

Рис. 25.Положение головы при интубации трахеи (по A.A. Бунятяну): а — классическое положение положение Джексона; б — улучшенное положение Джексона; в — неправильное положение
Современные ларингоскопы позволяют вводить эндотрахеальную трубку в трахею только в положении справа от клинка, поэтому анестезиолог должен держать ларингоскоп в левой руке, оттесняя клинком язык пациента влево и вверх. Перед введением ларингоскопа необходимо пальцами раздвинуть губы пациента во избежание их повреждения в результате прижатия их клинком к зубам. Если интубация выполняется с помощью ларингоскопа с прямым клинком, то клинок следует продвигать вперед, пока не станет виден надгортанник (рис. 26, а). Конец клинка следует ввести под надгортанник таким образом, чтобы одновременно поднять надгортанник и прижать корень языка (рис. 26, б).
|
|
|
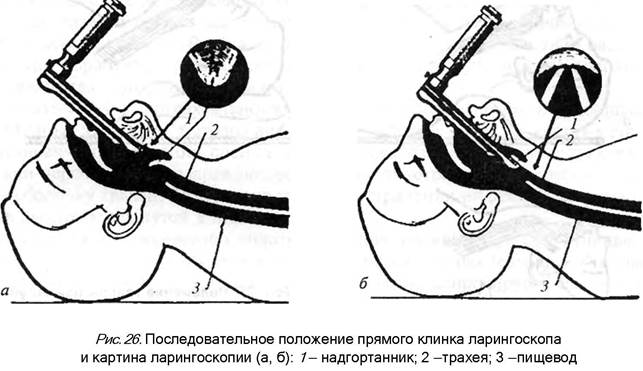
При использовании изогнутого клинка его конец необходимо продвинуть до язычно-надгортанной складки, затем прижать корень языка и поднять надгортанник (рис.27)..

Эндотрахеальная трубка вводится в трахею под визуальным контролем и продвигается вперед до исчезновения за голосовыми связками всей надувной муфты.Для контроля правильности выполнения интубации необходимо нажать на грудную клетку пациента (при этом должна тактильно ощущаться струя воздуха, выходящая из интубационной трубки) и с помощью мешка наркозного аппарата вдуть газовую смесь в легкие. Это должно вызывать равномерное расширение грудной клетки пациента, появление дыхательных шумов над обоими легкими и струи воздуха, выходящего из интубационной трубки в фазе выдоха.
При введении трубки в один из главных бронхов на противоположной стороне над поверхностью грудной клетки дыхательные шумы не прослушиваются. При введении трубки в пищевод во время искусственной вентиляции легких наблюдается экскурсия не грудной клетки, а надчревной области, отсутствуют дыхательные шумы над поверхностью легких, после чего вскоре возникает цианоз. Наиболее достоверным критерием нахождения интубационной трубки в трахее является показатель капнографа — значение РаС02 в выдыхаемом воздухе. Если трубка находится в пищеводе, этот показатель будет иметь значение менее 25 мм рт. ст., при нахождении ее в трахее — будет превышать это значение.
Реже применяется интубация трахеи вслепую (без ларингоскопа, наощупь), при необходимости - назотрахеальная интубация, при сложной интубации используют фибробронхоскоп или трахеостомию.
Поддержание наркоза на необходимом уровне осуществляется при помощи одного из анестетиков или их комбинации, дробными дозами вводят недеполяризирующие миорелаксанты.
Следует заметить, что при современном многокомпонентном наркозе контроль его глубины по клиническим признакам затруднен. Клинические тесты определения глубины наркоза в значительной мере утратили свою достоверность,поскольку большинство из них основано на наблюдении за деятельностью скелетных мышц. Таким образом, при эндотрахеальном наркозе практически выделяют лишь две стадии — поверхностную и глубокую.
|
|
|
При поверхностном наркозе сохраняются реакция зрачков на свет и слезотечение, а после прекращения действия миорелаксантов проявляются и другие признаки недостаточности глубины анестезии. При чрезмерном углублении наркоза проявляются признаки нарушения гемодинамики и другие признаки передозировки анестетиков.
Окончание наркоза. При эндотрахеальном наркозе особо ответственным является последний этап анестезии — выход пациента из наркоза. Это связано с тем, что организм пациента во время наркоза находился в противоестественных условиях (миорелаксация, угнетение рефлекторной активности, искусственная вентиляция легких газовой смесью с высоким содержанием кислорода). При пробуждении организм вынужден перестраиваться на естественные условия функционирования. Это требует напряжения его адаптационных систем. Их перегрузка может привести к срыву компенсации. Поэтому анестезиолог обязан обеспечить медленный выход пациента из наркоза и компенсировать нарушения гомеостаза, возникшие за время наркоза. Скорость пробуждения зависит от вида анестетика, продолжительности наркоза, характера оперативного вмешательства, выраженности патофизиологических изменений и ряда других факторов.
Проведение искусственной вентиляции легких должно быть прекращено при восстановлении у пациента адекватного дыхания, однако необходимо учитывать и другие признаки: экстубация проводится лишь после полного восстановления сознания пациента, кашлевого рефлекса, мышечной силы (пациент может поднять голову, пожать протянутую руку и т. п.), отсутствия гипоксемии. При самостоятельном дыхании в фазе вдоха не должны принимать участие вспомогательные мышцы и втягиваться межреберные промежутки. Необходимо дождаться восстановления синхронного грудного и диафрагмального дыхания. Объективным показателем неэффективности спонтанной вентиляции легких является появление цианоза и гемодинамических измененений после прекращения искусственной вентиляции легких (гипертензия, тахикардия, гипотензия, возникновение сердечной аритмии и др.). Безопаснее выполнять экстубацию при непрерывном наблюдении за функциями дыхания и кровообращения (пульсоксиметрия, контроль артериального давления, капнометрия).
Осложнения эндотрахеального наркоза.
Одним из наиболее частых осложнений интубации трахеи считается так называемая интубационная реакция сердечно-сосудистой системы, которая выражается в артериальной гипертензии, тахикардии и может представлять опасность для пациентов, у которых существует повышенный риск возникновения заболеваний сердечно-сосудистых системы. Для профилактики этой реакции применяется комбинированный наркоз с введением фентанила; для пациентов с очень высоким риском сердечно-сосудистых заболеваний можно применять лидокаин (до 1,5 мг/кг) за 5 мин до интубации. Применение пропофола в таких случаях более оправдано, чем натрия тиопентала.
Неполное расслабление мышц нижней челюсти и шеи перед интубацией при недостаточном опыте анестезиолога может привести к повреждению зубов и слизистой оболочки глотки с образованием ссадин, кровоизлияний в частях языка, зева, мягкого нёба, задней стенке глотки. При очень грубых манипуляциях при введении интубационной трубки возможны даже перелом челюсти, повреждение голосовых связок и рыхлой клетчатки подсвязочного пространства. Особую опасность при неправильной интубации представляет повреждение сосудистых сплетений задней стенки глотки с возможным интенсивным кровотечением, которое может значительно затруднить интубацию и даже вентиляцию с помощью маски и привести к асфиксии. При неправильной интубации трахеи через нос можно повредить рыхлую слизистую оболочку носовых ходов и этим также вызвать значительное кровотечение.
При ошибочной интубации в пищевод возможна перфорация его стенки с развитием тяжелых осложнений. Предположения в отношении перфорации пищевода должны возникнуть при условии появления крови на конце интубационной трубки, а крепитация в области шеи, свидетельствующая о попадании воздуха в подкожную жировую клетчатку, подтверждает высокую вероятность этого осложнения.
Регургитация, а затем аспирация'содержимого желудка в дыхательные пути также являются частыми осложнениями интубации трахеи. Особенно часто они возникают при ургентных операциях. Регургитация происходит, в основном, при переполненном желудке после введения миорелаксантов. К ее развитию приводят также фибрилляция мышц после введения деполяризирующих миорелаксантов и высокий дыхательный объем при искусственной вентиляции легких с помощью маски (в случае попадания воздуха в желудок с повышением внутрижелудочного давления). С целью профилактики этого осложнения необходимо строго следить за тем, чтобы перед операцией у пациента был пустой желудок. Экстренное опорожнение желудка с помощью зонда при наличии в нем содержимого во время операции не всегда безопасно. Особенно опасно вводить зонд пациентам, находящимся в коматозном состоянии и очень ослабленным. В случаях, когда предполагается развитие регургитации (полный желудок, кишечная непроходимость), следует проводить интубацию трахеи в положении пациента лежа на спине с поднятым на 30 0 изголовьем стола (применять этот способ для пациентов, склонных к артериальной гипотензии, нельзя), а также использовать прием Селика (сдавливать пищевод, нажимая на перстневидный хрящ во время фибрилляции мышц в момент интубации трахеи, как показано на рис. 29).

Рис. 29. Прийом Селика
Особую опасность представляет поступление в дыхательные пути содержимого желудка, имеющего резко повышенную кислотность (pH < 2,5). При этом могут развиваться тяжелый пневмонит (синдром Мендельсона) и острый респираторный дистресс-синдром. Терапия этого осложнения заключается в прекращении подачи анестетика, удалении из дыхательных путей содержимого желудка (с помощью отсасывания), в обязательном порядке — в наиболее раннем применении фибробронхоскопии с промыванием бронхиального дерева под визуальным контролем небольшим количеством изотонического раствора натрия хлорида и удалением остатков пищи. Также при этом пациенту назначают глюкокортикои- ды; для предупреждения пневмонии применяют антибиотики.
Минимальный риск аспирации желудочного содержимого обеспечивается при интубации под местной анестезией.
Осложнения, связанные с эндотрахеальным способом анестезии, преимущественно проявляются в нарушении легочной вентиляции в результате потери герметичности в системе «аппарат—пациент», неправильного положения трубки в гортани (попадание ее в пищевод, один из главных бронхов, чаще в правый, с развитием асфиксии, поскольку из вентиляции исключается левое легкое и верхняя доля правого легкого), при ухудшении проходимости эндотрахеальной трубки при ее перегибе, сдавливании, прикусывании пациента, обтурации интубационной трубки гноем, слизью, кровью. Возможно также закрытие просвета трубки при наползании на нее перераздутой манжеткой («манжеточной грыжей»), прижатие скоса трубки к стенке трахеи в результате чего она действует как клапан, и газовая смесь поступает в легкие, перераздувая их, в то время как обратный ее выход из легких затруднен (клиническая картина при этом напоминает бронхиолоспазм).
Осложнения в посленаркозный период возникают, в основном, после травматичной интубации трахеи и при преждевременной экстубации. Возникающий при этом отек слизистой оболочки гортани и голосовых связок может привести к развитию у пациента острой дыхательной недостаточности и даже асфиксии. Для устранения этого осложнения назначают длительную непрерывную ингаляцию кислорода, глюкокортико иды, антигисгаминные препараты (дифенгидрамин/ди-медрол, хлоропирамин/супрастин, прометазин/дипразин и др.).
При отсутствии наркотического эффекта в процессе операции может возникнуть необходимость в продлении назотрахеальной интубации или трахеостомии. Нередко осложнениями интубационного наркоза являются трахеит, ларингит или фарингит, вызваные повреждением интубационной трубкой слизистой оболочки гортани или глотки, тугой тампонадой ротоглотки, продолжительным пребыванием интубационной трубки в трахее. При этом у пациента отмечаются боль во время глотания, осиплость голоса и другие неприятные ощущения. Как правило, они проходят через 2—3 суток после интубации.
НЕИНГАЛЯЦИОННЫЙ НАРКОЗ
Наиболее распространенным видом неингаляционного наркоза в настоящее время является внутривенный. Значительно реже применяются прямокишечный, внутримышечный, внутрикостный, подкожный, гипно-и электронаркоз. Некоторые из этих видов наркоза (например, подкожный) имеют лишь историческое значение, поскольку в настоящее время не применяются. Другие виды наркоза (прямокишечный, внутримышечный, гипнонаркоз) применяются ограниченно, в случае наличия особых показаний. Некоторые виды (в частности лектронаркоз) в настоящее время находятся еще в стадии разработки и изучения.
Требования к оптимальному анестетику для внутривенного применения:
быстрое действие;
быстрое восстановление сознания пациента после наркоза;
аналгезии в субнаркотических концентрациях;
минимальное угнетение сердечно-сосудистой и дыхательной систем при его применении;
водорастворимость препарата;
возможность продолжительного его хранения;
химическая инертность по отношению к миорелаксантам;
безопасность при случайном введении его в артерию.
Также необходимо, чтобы препарат не вызывал у пациента возбуждение, рвоту, галлюцинации, болей в месте введения, не раздражал венозную стенку, не оказывал токсического действия на различные органы и не способствовал высвобождению гистамина.В настоящее время ни один из применяемых неингаляционных анестетиков не обладает одновременно всеми перечисленными свойствами.
В современной анестезиологической практике для внутривенного введения чаще всего используют следующие анестетики: натрия тиопентал, пропофол, мидазолам, кетамин, этомидат; в странах постсоветского пространства широко применяется натрия оксибутират.
Натрия тиопентал
Натрия тиопентал (пентотал) — кристаллический порошок желтоватого или желто-зеленого оттенка, имеющий слабый запах чеснока. Его водный раствор имеет сильную щелочную реакцию (pH 10—11). 1—2 % раствор готовят непосредственно перед внутривенным введением. Общая доза препарата при одноразовом применении не должна превышать 1 г сухого вещества. Чаще всего натрия тиопентал вводят взрослым в дозе 5—8 мг/кг, а детям — 6—10 мг/кг, подбирая при этом дозу индивидуально в зависимости от состояния пациента.
Отключение сознания наступает через 1,5—2 мин после введения препарата, наркотический сон длится 20—25 мин. При случайном подкожном введении натрия тиопентал может вызвать некроз подкожной жировой клетчатки, а при попадании в артерию — ее резкий спазм, который может привести к развитию гангрены конечности.
Действие натрия тиопентала на организм. При попадании барбитуратов (к которым относится и натрия тиопентал) в кровь 75 % от их количества связывается белками, и лишь 25 % оказывает наркотическое действие. Поэтому при гипопротеинемии наркотический эффект, вызываемый этими препаратами, усиливается. Степень связывания барбитуратов белками зависит от pH крови: при ацидозе она снижается, что повышает чувствительность организма к барбитуратам, а при алкалозе — возрастает. Барбитураты поглощаются органами и тканями (сердцем, почками, центральной нервной системой, печенью и др.) с последующей интенсивной их перфузией.
Решающую роль в метаболизме и последующем распаде барбитуратов играет печень. Инактивация их в печени в значительной мере зависит от интенсивности углеводного обмена в ней. В печени, бедной гликогеном, барбитураты распадаются значительно медленнее. В терапевтических дозах барбитураты не оказывают отрицательного действия на здоровую печень. При нарушениях функции печени под действием барбитуратов они могут усугубляться. На функцию почек барбитураты непосредственно не влияют.
При гипоксии окисление барбитуратов замедляется, а время их действия продляется.
Наркотическое действие барбитуратов обусловлено их угнетающим действием на ретикулярную формацию ствола мозга. Производные барбитуровой кислоты обладают наркотическим действием, однако не вызывают анальгетического эффекта.
Барбитураты оказывают угнетающее действие на дыхание, степень которого прямо зависит от скорости введения анестетика и концентрации его в крови. Угнетение дыхания проявляется в снижении его частоты и глубины, вплоть до полной остановки. Однако даже при глубоком барбитуровом наркозе сохраняются глоточные и гортанные рефлексы. При наркозе натрия тиопенталом наблюдается повышение тонуса бронхиальных мышц. Поэтому раздражение интубационной трубкой гортани и глотки при этом наркозе может вызвать кашель, икоту, ларингоспазм. Усиление тонуса блуждающего нерва в результате действия препарата может привести к спазму бронхиол или остановке сердца во время интубации или бронхоскопии.
Барбитураты оказывают выраженное действие на сердечно-сосудистую систему, вызывая уменьшение систолического выброса сердца, снижение тонуса периферичеких сосудов (вен и артерий мышечного типа) и снижение интенсивности мозгового кровообращения на 20—30 %. Сочетание этих факторов вызывает развитие артериальной гипотензии.
Показания к применению препарата. Производные барбитуровой кислоты применяются главным образом для введения в наркоз, гораздо реже используются для обезболивания при кратковременных оперативных вмешательствах, болезненных лечебных и диагностических манипуляциях, при кардиоверсии.
Противопоказания. Абсолютными противопоказаними являются наличие в анамнезе пациента случаев возникновения аллергических реакций на введение препаратов, порфирия, отсутствие при операции анестезиолога и аппарата для искусственной вентиляции легких. Относительные противопоказания: скрытый спазм бронхиол или бронхиальная астма, шок, коллапс, выраженная артериальная гипотензия, поражение паренхимы печени, болезнь Аддисона, тяжелая гипопротеинемия и метаболический ацидоз, обширные ожоги и порфирурия.
Методика проведения и клиническая картина наркоза барбитуратами. Натрия тиопентал вводится медленно внутривенно, сначала в количестве 2—3 мл 1—2 % раствора для выяснения, нет ли у пациента повышенной чувствительности к анестетику, не попал ли раствор под кожу, а через 20—30 с вводится остальная доза препарата со скоростью 5—10 мл в 1 мин. Показаниями для прекращения введения анестетика являются: отключение у пациента сознания, исчезновение реснитчатого рефлекса, сужение зрачков, установление глазных яблок по оси орбит, расслабление мышц нижней челюсти. Перед интубацией трахеи такой глубины наркоза достигать необходимо не всегда. Через несколько секунд после инъекции у пациента появляется сонливость, веки тяжелеют, быстро и незаметно теряется сознание. Перед его потерей иногда возникает кратковременное состояние эйфории.
Выделить стадии наркоза производными барбитуровой кислоты, как при наркозе эфиром, невозможно. Первая стадия отсутствует, так как барбитураты не вызывают анальгетический эффект. Вторая стадия ярко не выражена. Для нее лишь характерно усиление глоточных и гортанных рефлексов, рефлексов блуждающего нерва, в связи с чем интубацию в этой стадии проводить опасно. Нельзя также начинать оперативное вмешательство, поскольку у пациента в этой стадии наркоза, несмотря на отключение сознания, сохраняются вегетативные и защитные двигательные реакции. У отдельных пациентов наступает кратковременное, иногда бурное возбуждение.
Оперативное вмешательство при мононаркозе барбитуратами возможно произвести лишь в третьей (хирургической) стадии, при которой у пациента исчезает защитная реакция на боль, снижается тонус мышц, суживаются зрачки, замедляется их реакция на свет. Дыхание в это время становится замедленным и поверхностным, артериальное давление начинает снижаться. Хирургическая стадия наркоза наступает после введения натрия тиопентала в дозе 8—10 мг/кг, но в настоящее время такая методика введения в наркоз практически не используется.
Преимущества натрия тиопентала: 1) простота применения; 2) быстрое введение в наркоз (без возбуждения, рвоты и неприятных ощущений); 3) отсутствие раздражения ним дыхательных путей.
Недостатки натрия тиопентала: 1) обладает относительно малым терапевтическим диапозоном; 2) не вызывает анальгетического эффекта; 3) усложняет управление глубиной наркоза; 4) оказывает ваготоническое действие, увеличивающее вероятность возникновения ларингоспазма; 5) вызывает ярко выраженное угнетение дыхания и сердечно-сосудистой деятельности; 6) вызывает продолжительную постнаркотическую депрессию; 7) не обеспечивает достаточную миорелаксацию; 8) не устраняет глоточные и гортанные рефлексы; 9) вызывает раздражение при попадании его под кожу и в артерию.
Кетамин
Кетамин (кетамина гидрохлорид, кеталар, калипсол) — производное фенциклидина, анестетик для внутривенного и внутримышечного введения. Выпускается в форме водного раствора во флаконах по 20 мл 1 % раствора для внутривенного применения, или по 10 мл 5 % раствора для внутримышечного введения,или в ампулах по 2 мл 5 % раствора. Особенностью этого препарата является выраженная блокада проведения и восприятия болевых импульсов при минимальном влиянии на ретикулярную формацию и лимбическую систему мозга.
Наркоз, вызваный кетамином, угнетает функции одних отделов центральной нервной системы и повышает активность других, поэтому он получил название диссоциативного. Этим механизмом действия препарата вероятно и вызвано развитие бреда и галлюцинаций в посленаркозный период у 10—30 % пациентов.
Кетамин метаболизируется печеночными микросомальными ферментами.
Действие кетамина на организм. На кровообращение препарат оказывает специфическое действие: через 3—5 мин после его инъекции повышается артериальное (на 20—30 %) и венозное давление (на 35—60 %), учащается пульс (на 30— 38 %), увеличиваются минутный объем сердечного выброса (на 10—20 %) и общее сопротивление периферических сосудов (на 8—11 %). Повторное введение кетамина не усиливает возникших изменений; напротив, пульс нормализуется, артериальное давление остается несколько повышенным (на 10—30 мм рт. ст. по сравнению с начальным). Стимулирование деятельности сердца под действием препарата обусловлено высвобождением катехоламинов. Кетамин не вызывает сердечной аритмии и сенсибилизации миокарда к катехоламинам. Гипертензию и тахикардию, возникающие при введении препарата, можно снизить введением диазепама.
Кетамин обеспечивает аналгезию, степень которой зависит от дозы препарата. В отличие от других анестетиков, вызывающих состояние, сходное с нормальным сном, кетамин обуславливает развитие состояния, напоминающего каталепсию. Во время наркоза кетамином большая часть защитных рефлексов сохраняется (роговичный, кашлевой, глотательный).
В хирургической стадии наркоза кетамин не угнетает дыхание, однако в первые минуты после внутривенного введения возможно кратковременное нарушение проходимости дыхательных путей, вызванное спазмом жевательных мышц или западанием корня языка. Препарат оказывает бронхолитическое действие, так как расслабляет гладкую мускулатуру бронхов.
Кетамин легко проникает через гематоэнцефалический барьер, поэтому его действие проявляется уже через 30 с, а максимальный наркотический эффект развивается в пределах 1 мин. После введения кетамина зрачки умеренно расширяются, наблюдаются слезотечение и саливация, повышается тонус мышц, который часто сопровождается некоординированными движениями конечностей и головы.
Продолжительность анестезии после внутривенного введения кетамина в дозе 2 мг/кг составляет 10—15 мин, а полное восстановление ориентации в пространстве и времени наступает у пациента через 15—30 мин после выхода из наркоза. После анестезии кетамином наблюдается продолжительный период послеоперационной аналгезии.
Кетамин стимулирует метаболизм мозга и мозговой кровоток, а также повышает внутричерепное давление. Не влияет на функцию печени и почек.
Показания к применению преперата. Мононаркоз кетамином рекомендуется для обезболивания при операциях и манипуляциях, не требующих миорелакса-ции (при локальных оперативных вмешательствах в офтальмологии, детской и пластической хирургии, стоматологии). Кетамин применяется при спинномозговых и плевральных пункциях и дренировании плевральной полости. Также его можно применять для индукции наркоза при заболеваниях дыхательных путей, обезболивании при родах и кесаревом сечении. Основанием для применения препарата в этих случаях является отсутствие у него угнетающего действия на дыхание плода, так как кетамин не проникает через плацентарный барьер. Препарат можно с успехом использовать в качестве дополнения к регионарной анестезии в дозе 0,5 мг/кг внутривенно в сочетании с диазепамом (0,15 мг/кг). В невысоких дозах его можно назначать в комбинации с закисью азота в амбулаторной практике.
Учитывая отсутствие угнетающего действия кетамина на кровообращение, показан для обезболивания в качестве одного из компонентов анестезии при политравмах, в состоянии шока, пациентам с пороками сердца и высоким операционным риском. Дозы препарата таким пациентам снижают в 2—3 раза. Кетамин применяется также при некоторых ортопедических и онкологических операциях, а также при обезболивании в абдоминальной хирургии. Препарат особенно показан детям для седации и обезболивания, при выполнении несложных хирургических манипуляций (катетеризации сосудов, сердца, смене повязок), в стоматологической практике и др.
Противопоказания. Кетамин не применяется в отношении лиц, страдающих артериальной гипертензией, ишемической болезнью сердца, заболеваниями сосудов мозга, аневризмами сосудов грудной и брюшной полости, алкоголизмом и эпилепсией, психическими заболеваниями.
Нерешенным остается вопрос об использовании кетамина в нейрохирургической практике. В качестве средства для мононаркоза в настоящее время он применяется очень редко.
Методика проведения и клиническая картина наркоза кетамином. Методика проведения наркоза кетамином такая же, как и при других видах внутривенного наркоза. Премедикация проводится с обязательным включением в ее состав атропина и бензодиазепина. При кратковременных хирургических вмешательствах, не требующих в миорелаксации, препарат вводится внутримышечно в дозе 5—6 мг/кг. Через 20—30 мин для поддержания наркоза препарат вводится дополнительно в дозе 3 мг/кг. При продолжительных травматичных оперативных вмешательствах его постепенно вводят внутривенно в дозе 2—4 мг/кг в течение 2 мин. После отключения у пациента сознания ему вводятся миорелаксангы и начинают производиться искусственная вентиляция легких. Через 20—30 мин препарат вводится повторно в поддерживающий дозе 0,5 мг/кг.
Хирургическая стадия наркоза при применении кетамина достигается через 1—2 мин после внутривенного и через 6—8 мин после внутримышечного введения препарата и длится соответственно 10—15 и 30—40 мин. Сознание у пациента после наркоза восстанавливается быстро, но полное пробуждение может наступить лишь в течение 3 ч.
Клиническая картина наркоза кетамином характеризуется повышением тонуса мышц. Даже после отключения у пациента сознания и исчезновения реакции на болевые раздражители глоточный и гортанный рефлексы сохраняются. В настоящее время отмечены случаи возникновения вертикального и горизонтального нистагма.
Пропофол
Пропофол (диприван, рекофол) — анестетик кратковременного действия. Нерастворим в воде. В клинической практике применяется в форме эмульсии, содержащей кроме профола соевое масло, глицерол и яичный лецитин. Эмульсия выпускается в ампулах по 20 мл, содержащих 200 мг пропофола (10 мг/мл), а также во флаконах по 50 и 100 мл в форме 1 или 2 % раствора для инфузий. Действие препарата наступает через 20—40 с после его внутривенного введения, продолжительность наркотического эффекта — 6—8 мин. Быстрое наступление эффекта обусловлено высокой липофильностью пропофола и легким прохождением его через гематоэнцефалический барьер. Пропофол метаболизируется в печени с образованием неактивных глюкуронидн
|
|
|


