 |
Трипсин. Химотрипсин. Эластаза. Карбоксипептидазы. Аминопептидазы. Дипептидазы. Лизосомы энтероцитов. 8.Биологическая ценность белков
|
|
|
|
Трипсин
Синтезируемый поджелудочной железой трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина.
Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина, может осуществлять аутокатализ, т. е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу.
Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу панкреатической липазы, отвечающей за гидролиз триацилглицеролов.
В таких продуктах, как бобовые (соя, горох, фасоль) содержится пептид – ингибитор трипсина, снижающий переваривание белков этих продуктов в сыром, термически необработанном, виде.
 Схема активации трипсина
Схема активации трипсина
|  Схема активации химотрипсина
Схема активации химотрипсина
|
Химотрипсин
Образуется из химотрипсиногена при участии трипсина, который расщепляет пептидную связь между аргинином-15 и изолейцином-16 с образованием уже активных промежуточных форм π -химотрипсина и δ -химотрипсина, которые аутолизисом удаляют два дипептида из собственных цепей. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей, формируя стабильный α -химотрипсин.
Фермент специфичен к пептидным связям, образованных с участием карбоксильных групп ароматических аминокислот – фенилаланина, тирозина и триптофана.
|
|
|
Эластаза
Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот – аланина, пролина, глицина.
Карбоксипептидазы
Карбоксипептидазы являются экзопептидазами, они гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки основных аминокислот – лизина и аргинина.
Аминопептидазы
Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Представителями аминопептидаз являются аланин-аминопептидаза и лейцин-аминопептидаза, обладающие широкой специфичностью. Например, лейцин-аминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы
Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Лизосомы энтероцитов
Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами.
8. Биологическая ценность белков
Обмен белков занимает особое место в многообразных превращениях веществ, характерных для всех живых организмов. Существенное влияние на белковый обмен оказывает характер питания, в частности, количество принимаемого с пищей белка и его качественный состав.
При недостаточном поступлении белков с пищей распад тканевых белков организма превосходит их синтез. Принятые нормы белка для человека учитывают разные климатические условия, возраст, условия труда, профессию и другие факторы.
Суточная потребность человека в белках составляет 100-120 г при трате общего количества энергии 12 000 кДж, для людей физического труда – 130-150 г, а для детей раннего возраста – 55-72 г. Отсутствие или недостаток белков в пище сопровождается задержкой роста, падением веса тела и вызывает ряд общих патологических изменений в организме. Особенно чувствительны к белковому голоданию нервная и эндокринная система, и в первую очередь кора головного мозга.
|
|
|
Состояние белкового обмена в организме зависит не только от количества принимаемого с пищей белка, но и от его качественного состава, определяющего биологическую ценность пищевых белков.
Принимаемые с пищей белки значительно отличаются по своему аминокислотному составу и биологической ценности. Биологическая ценность белков определяется, главным образом, следующими факторами:
– Близостью аминокислотного состава пищевого белка к аминокислотному составу белков тела. Чем ближе аминокислотный состав принимаемого пищевого белка к аминокислотному составу белков организма, тем выше его биологическая ценность. Для человека, например, белки мяса, молока, яиц биологически более ценны, поскольку их аминокислотный состав ближе к аминокислотному составу органов и тканей человека. Однако это не исключает приема растительных белков, в которых содержится необходимый набор аминокислот, но в другом соотношении.
– Степенью усвоения пищевого белка. Степень усвоения любого пищевого продукта зависит также от эффективности его распада под влиянием ферментов желудочно-кишечного тракта. Ряд белковых веществ, например, фиброин шелка, кератин волос, рогов, копыт и др., несмотря на их близкий аминокислотный состав к белкам тела человека, почти не используются в качестве пищевого белка, поскольку они не гидролизуются протеиназами желудочно-кишечного тракта человека и большинства животных.
– Содержанием в белках незаменимых аминокислот. Известно, что из 20 аминокислот, входящих в состав белков, только 10 способны синтезироваться в организме человека и животных – это заменимые аминокислоты, остальные 10 аминокислот (валин, лейцин, изолейцин, треонин, метионин, триптофан, фенилаланин, лизин, гистидин, аргинин) не синтезируются в организме и являются незаменимыми. Такие аминокислоты, как гистидин и аргинин относятся к полузаменимым (частично заменимым), т. е. они могут синтезироваться в организме, но в количестве, недостаточном для сохранения нормальной жизнедеятельности человека. Следовательно, незаменимые аминокислоты должны быть обязательно введены в организм человека или животного с пищей. Если их будет в пище недостаточно, то нормальное развитие и жизнедеятельность организма нарушаются.
|
|
|
Также следует отметить, что недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот.
Вместе с тем было доказано, что потребности отдельных незаменимых аминокислот могут быть частично компенсированы заменимыми аминокислотами. Например, тирозин снижает потребность в фенилаланине, цистеин снижает потребность в метионине, а глутаминовая кислота в аргинине.
Для оценки биологической ценности пищевого белка важное значение имеет знание его аминокислотного состава. Отдельные белки могут быть биологически неполноценны по своему аминокислотному составу. Однако необходимо исследовать аминокислотный состав не отдельных белков, а всего их комплекса, содержащегося в пищевом продукте. Только при таком подходе могут быть получены правильные данные об аминокислотном составе, а следовательно, и о пищевой ценности продукта. Так, например, цельное кукурузное зерно содержит 2, 5% лизина, 0, 7% триптофана, в то время как выделенный из кукурузы белок зеин не содержит лизина вообще, а триптофана в нем всего 0, 1%. Поэтому, для питания большое значение имеет сбалансированность аминокислотного состава белков.
По содержанию в белке незаменимых аминокислот, определяемых химическими методами, вычисляют аминокислотный скор, которым характеризуют биологическую ценность белка. В продукте определяют содержание каждой незаменимой аминокислоты. Найденное количество вычисляют в процентах к содержанию той же аминокислоты в идеальном белке (куриного яйца, молока). Чаще всего в качестве идеального белка принимают аминокислотную шкалу комитета ФАО/ВОЗ. Аминокислотный скор каждой незаменимой аминокислоты в идеальном белке (шкале ФАО/ВОЗ) принимают за 100 %. Расчет скора ведут по формуле
|
|
|
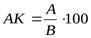 , ,
| (1) |
где А – количество, мг, незаменимой аминокислоты в 1 г исследуемого белка;
В – количество, мг, этой же незаменимой аминокислоты в 1 г идеального белка (данные аминокислотной шкалы ФАО/ВОЗ).
По вычисленному скору определяют лимитирующую биологическую ценность изучаемого белка – аминокислоту с наименьшим скором.
Таким образом, для нормального роста и гармоничного развития организма человека большое значение имеют составление и подбор пищевых продуктов, содержащих оптимальный аминокислотный состав и обеспечивающих физиологически полноценное питание для различных групп населения.
|
|
|


