 |
Ведение больных после выписки из стационара 6 глава
|
|
|
|
При осмотре обращает на себя внимание тяжелое общее состояние больного. В самом начале развития кардиогенного шока возможно кратковременное психомоторное возбуждение (эректильная фаза шока). Однако вскоре больной становится вялым, адинамичным, почти не реагирует на окружающее, что указывает на быстрое прогрессирование гипоксии, ацидоза, снижение мозгового кровотока (торпидная фаза). Сознание в это время может быть угнетено, вплоть до комы.
Кожные покровы бледные с выраженным цианотическим оттенком. Отмечается профузный пот, конечности холодные на ощупь.
Пульс на лучевых артериях малого наполнения и напряжения, нитевидный (pulsus filiformis), иногда вообще отсутствует. Артериальное давление резко снижено, систолическое АД меньше 80 мм рт. ст., хотя следует помнить, что кардиогенный шок может развиться и при более высоких цифрах АД (90–100 мм рт. ст.), если у больного в прошлом имела место АГ. Для кардиогенного шока более характерно резкое уменьшение пульсового АД (менее 30 мм рт. ст.). Например, 80/60 мм рт. ст. или 70/50 мм рт. ст. При определении АД слышны очень глухие тоны Н.С. Короткова. В тяжелых случаях тоны Короткова исчезают вообще, и АД не определяется аускультативным методом.
При исследовании легких выявляется частое поверхностное дыхание, а в терминальной стадии — апериодическое дыхание Чейна–Стокса. В легких выслушиваются влажные хрипы, что указывает на признаки застоя крови в малом круге кровообращения и развивающийся отек легких.
При аускультации тоны сердца глухие, часто аритмичные, может выслушиваться протодиастолический ритм галопа, систолический шум.
Одним из наиболее надежных клинических признаков кардиогенного шока является олиго- и анурия (диурез меньше 30 мл/ч), которые являются весьма неблагоприятными прогностическим признаками.
|
|
|
 Запомните
Наиболее характерными клиническими проявлениями кардиогенного шока являются: 1. Снижение систолического АД ниже 80 мм рт. ст. и пульсового АД ниже 30 мм рт. ст. 2. Олигурия и анурия (диурез меньше 30 мл/ч). 3. Нитевидный пульс на лучевых артериях. 4. Адинамия, апатия, отсутствие реакции на окружающее, нарушение сознания, вплоть до комы. 5. Бледность кожи, цианоз, липкий профузный пот, похолодание конечностей. 6. Признаки сопутствующего отека легких (интерстициального или альвеолярного) Запомните
Наиболее характерными клиническими проявлениями кардиогенного шока являются: 1. Снижение систолического АД ниже 80 мм рт. ст. и пульсового АД ниже 30 мм рт. ст. 2. Олигурия и анурия (диурез меньше 30 мл/ч). 3. Нитевидный пульс на лучевых артериях. 4. Адинамия, апатия, отсутствие реакции на окружающее, нарушение сознания, вплоть до комы. 5. Бледность кожи, цианоз, липкий профузный пот, похолодание конечностей. 6. Признаки сопутствующего отека легких (интерстициального или альвеолярного)
|
Следует также добавить, что довольно часто в отечественной и зарубежной литературе термин “кардиогенный шок” используют для обозначения еще двух патологических состояний, также сопровождающихся снижением сердечного выброса и АД, но существенно отличающихся от истинного кардиогенного шока по механизмам своего развития и прогнозу.
1. Рефлекторная форма шока (рефлекторный коллапс, болевой рефлекторный шок) является своеобразной формой острой сосудистой недостаточности, которая в большинстве случаев развивается на высоте болевого приступа. Рефлекторная форма шока обусловлена внезапным уменьшением тонуса вен и депонированием значительной части крови в венах органов брюшной полости и скелетных мышц. При этом резко уменьшается приток крови к сердцу, снижается сердечный выброс и происходит кратковременное нарушение перфузии головного мозга, что и определяет клиническую картину рефлекторного шока (коллапса).
Клиническая картина рефлекторного шока у больных ИМ была подробно описана выше. В отличие от истинного кардиогенного шока болевой рефлекторный коллапс обычно продолжается недолго, легко купируется самостоятельно или после применения сосудистых препаратов, быстро повышающих венозный тонус и восстанавливающих исходную гемодинамику.
|
|
|
Рефлекторная форма шока (коллапса) наблюдается почти у всех больных ИМ с зубцом Q, как правило, в самом начале заболевания и практически не оказывает влияния на прогноз ИМ.
2. Аритмический шок обусловлен резким падением насосной функции ЛЖ и АД в результате возникновения пароксизмальной тахикардии или полной АВ-блокады. Купирование пароксизма тахикардии или применение электрокардиостимуляции сердца при АВ-блокаде приводит обычно к быстрому восстановлению сердечного выброса и нормализации АД.
В то же время следует помнить, что наличие у больного клинической картины шока и тяжелых нарушений ритма и проводимости еще не означает, что речь идет именно об аритмическом шоке, поскольку истинный кардиогенный шок также может сопровождаться тяжелыми аритмиями. Окончательное суждение о генезе шока можно сделать только после купирования нарушений ритма и проводимости: при истинном кардиогенном шоке устранение аритмии не оказывает влияния на насосную функцию ЛЖ, и клинические признаки шока сохраняются.
Для клинической оценки выраженности острой левожелудочковой недостаточности у больных ИМ используют простую классификацию Т.Killip и J. Kimball (1969), основанную на количественной характеристике некоторых клинических проявлений сердечной недостаточности. Классификация представлена в табл. 6.9.
то же время следует помнить, что наличие у больного клинической картины шока и тяжелых нарушений ритма и проводимости еще не означает, что речь идет именно об аритмическом шоке, поскольку истинный кардиогенный шок также может сопровождаться тяжелыми аритмиями. Окончательное суждение о генезе шока можно сделать только после купирования нарушений ритма и проводимости: при истинном кардиогенном шоке устранение аритмии не оказывает влияния на насосную функцию ЛЖ, и клинические признаки шока сохраняются.
Для клинической оценки выраженности острой левожелудочковой недостаточности у больных ИМ используют простую классификацию Т.Killip и J. Kimball (1969), основанную на количественной характеристике некоторых клинических проявлений сердечной недостаточности. Классификация представлена в табл. 6.9.
Таблица 6.9
Классификация острой левожелудочковой недостаточности у больных инфарктом миокарда (по Killip, 1969 г.; в модификации)
|
|
|
| Класс острой СН | Клинические критерии | Удельный вес больных данного класса среди поступающих в БИТ, % | Госпитальная летальность, % |
| I | Отсутствие влажных хрипов в легких и патологического III тона | 30–40 | |
| II | Застойные влажные хрипы на площади менее 50% легочных полей и/или патологический III тон | 30–50 | |
| III | Влажные хрипы на площади более 50% легочных полей в сочетании с патологическим III тоном | 5–10 | |
| IV | Признаки кардиогенного шока | 80–100 |
Диагностика нарушений гемодинамики при острой левожелудочковой недостаточности
Для количественной и качественной оценки гемодинамических нарушений, лежащих в основе острой левожелудочковой недостаточности и кардиогенного шока у больных ИМ, используются следующие дополнительные методы исследования.
1. Рентгенография органов грудной клетки.
2. Катетеризация левых и правых отделов сердца с измерением давления в камерах сердца и легочной артерии.
3. Прямые методы определения сердечного выброса.
4. Радионуклидная вентрикулография.
5. Коронароангиография с левой вентрикулографией.
6. Эхокардиография и др.
Рентгенография органов грудной клетки позволяет объективизировать признаки венозного застоя крови в малом круге кровообращения, а катетеризация полостей сердца и легочной артерии — оценить уровень КДД в ЛЖ, давление наполнения ЛЖ, центральное венозное давление (ЦВД), а также УО, МО, СИ и другие гемодинамические параметры.
Рентгенография органов грудной клетки
Рентгенография органов грудной клетки является наиболее простым и доступным методом исследования, который позволяет оценить у больных ИМ кровообращение в малом круге и выявить признаки развивающегося отека легких, причем до появления отчетливых клинических проявлений этого осложнения (см. главу 2).
Напомним, что рентгенологически венозный застой крови в легких проявляется выраженным затемнением корней и периферических отделов легких и значительным расширением легочных вен (см. рис. 2.23, в и рис. 2.25). На этой начальной стадии гемодинамических нарушений наблюдается снижение пульсации корней легких, выявляемой при рентгеноскопии, и отсутствие расширения легочной артерии и ее крупных ветвей.
|
|
|
При присоединении к венозному застою признаков легочной артериальной гипертензии, обусловленной рефлекторным спазмом легочных артериол и мелких артерий (рефлекс Китаева) в ответ на повышение давления в левом предсердии выше 18 мм рт. ст., выявляются следующие рентгенологические признаки (см. рис. 2.23 и рис. 2.24).
1. Интенсивное гомогенное затемнение корней легких и их значительное расширение и нерезкость очертаний.
2. Обеднение легочного сосудистого рисунка на периферии обоих легких за счет выраженного сужения мелких артерий, дистальные отделы которых как бы “обрываются”. Это один из наиболее характерных рентгенологических признаков сочетания венозного полнокровия и легочной артериальной гипертензии, которое лежит в основе возникновения клинической картины гемодинамического отека легких.
3. Появление на рентгенограммах легких “ перегородочных” линий Керли типа В, образующихся вследствие накопления жидкости в междольковых прегородках (см. рис. 2.24,б).
4. Расширение и усиленная пульсация ствола легочной артерии и ее крупных ветвей (рентгенологический признак легочной артериальной гипертензии).
Следует помнить, что перечисленные рентгенологические признаки интерстициального отека легких у половины больных появляются раньше, чем описанные выше клинические симптомы острой левожелудочковой недостаточности.
Гемодинамический мониторинг
Всем больным ИМ, у которых выявляется острая сердечная недостаточность, показано определение и оценка в динамике, по меньшей мере, пяти гемодинамических показателей:
- сердечного индекса (СИ);
- фракции выброса ЛЖ (ФВ);
- центрального венозного давления (ЦВД) — давления в ПП;
- давления заклинивания легочной артерии (ДЗЛА);
- артериального давления (АД).
Сведения о динамике этих показателей крайне необходимы для объективной оценки типа гемодинамических нарушений, выбора оптимальной индивидуальной тактики ведения больных и контроля за лечением. Для определения этих показателей целесообразно использовать прямые инвазивные методы исследования: катетеризацию правых отделов сердца (определение ДЗЛА, ЦВД) и метод термодилюции (УО, МО, УИ, СИ, ФВ). Для оценки СИ и ФВ можно использовать также метод эхокардиографии и левой вентрикулографии. Кроме того, во всех случаях необходимо предусмотреть контроль за диурезом, причем при кардиогенном шоке — почасовой контроль с помощью постоянного мочевого катетера.
|
|
|
Катетеризация полостей сердца и магистральных сосудов. Катетеризацию правых и левых отделов сердца и магистральных сосудов должен выполнять высококвалифицированный медицинский персонал в хорошо оборудованных отделениях интенсивной терапии и кардиореанимации или специализированных ангиографических лабораториях, поскольку риск, связанный с осуществлением этих манипуляций, особенно катетеризации левых отделов сердца, достаточно высок.
Катетеризация правых отделов сердца. Для проведения катетеризации правых отделов сердца пунктируют бедренную вену, основную вену плеча или подключичную вену. Чаще используют последний доступ (рис. 6.46). Больного укладывают на операционный стол на спину. Пациент занимает положение с низким изголовьем; между лопатками кладут валик (рис. 6.46, а). Кожу правой подключичной области обрабатывают антисептическими средствами, а саму область отграничивают стерильными салфетками.
Пальцы левой руки располагают так, как это показано на рис. 6.46, б: указательный палец на яремную вырезку грудины, а большой палец — на место пересечения ключицы и первого ребра. Иглой диаметром около 0,5 мм в области, расположенной примерно на 2 см латеральнее большого пальца и чуть ниже ключицы, делают прокол и вводят 1% раствор лидокаина, осуществляя таким образом анестезию кожи, подкожной клетчатки и надкостницы ключицы. После того как подключичная область инфильтрирована анестетиком, ее пунктируют иглой Сельдингера, подсоединенной к стерильному шприцу. При этом игла располагается почти горизонтально и медленно продвигается под ключицу по направлению к указательному пальцу оператора. Срез иглы должен быть повернут вниз.
Если в шприце появилась темная венозная кровь, это указывает на то, что игла вошла в вену. Шприц отсоединяют и в просвет иглы вводят проводник, удерживая иглу в том же положении (рис. 6.46, в). После того как проводник попал в просвет вены, иглу извлекают, а на проводник надевают жесткий дилататор и вводят его по проводнику на 3 – 4 см. Он используется для расширения подкожных тканей. Затем расширитель удаляют и в проводник вводят центральный венозный катетер — на 15 см вглубь (рис. 6.46, г).

|
| Рис. 6.46. Пункция правой подключичной вены: а — положение пациента; б — введение в вену иглы Сельдингера; в — введение жесткого дилататора по проводнику, находящемуся в подключичной вене; г — схема расположения катетера в венах, правых отделах сердца и легочной артерии при подключичном доступе |
После этого проводник удаляют, аспирируют кровь из катетера и начинают струйное введение стерильного изотонического раствора натрия хлорида. Катетер фиксируют к коже швами.
Часто при зондировании правых отделов сердца используют доступ через бедренную вену. Ее анатомическое расположение и топографические взаимоотношения с бедренной артерией и нервом представлены на рис. 6.47. Техника пункции вены и введения катетера аналогична описанной ранее при подключичном доступе. Пунктируют бедренную вену медиальнее области, в которой была обнаружена пульсация бедренной артерии.

|
| Рис. 6.47. Место пункции бедренной вены для введения катетера в правые отделы сердца и легочную артерию. Объяснение в тексте |
Помимо описанного чрескожного введения центрального катетера в ряде случаев используют венесекцию.
В зависимости от цели исследования используют различные виды катетеров. Для контроля за гемодинамикой применяют так называемый “ плавающий ” катетер Свана – Ганца (Swan H., Ganz W., 1975), на конце которого расположен небольшой баллончик, раздуваемый газом (рис. 6.48). Катетер медленно вводят примерно до уровня правого предсердия, после чего баллончик раздувают. Катетер с раздутым баллончиком приобретает повышенную “ плавучесть ” и практически не оказывает механического воздействия на внутреннюю поверхность правых отделов сердца, что предупреждает возникновение нарушений сердечного ритма.

|
| Рис. 6.48. «Плавающий» катетер Свана–Ганца в полости правого желудочка (схема). На конце катетера небольшой резиновый баллончик, раздутый газом |
Катетер вводят в правое предсердие, правый желудочек и, наконец, в легочную артерию, регистрируя кривые давления в этих отделах сердца (рис. 6.49). Затем газ из баллончика эвакуируют и продвигают конец катетера в одно из разветвлений легочной артерии второго и третьего порядка. После этого вновь раздувают баллончик, который обтурирует (“ заклинивает ”) сосуд, что позволяет зарегистрировать так называемое легочно-капиллярное давление или, точнее, передаточное давление из ЛП, называемое “ давлением заклинивания легочной артерии ” (ДЗЛА). На рисунке видно, что в момент “ заклинивания ” легочной артерии характер кривой давления резко меняется
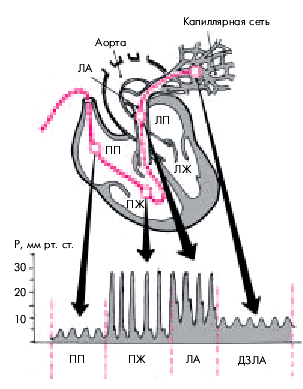
|
| Рис. 6.49. Схема введения «плавающего» катетера Свана–Ганца для измерения давления в полости ПП, ПЖ и в ЛА. Внизу — кривые давления (Р) в ПП, ПЖ, ЛА и давления заклинивания ЛА (ДЗЛА) |
 Запомните
Давление заклинивания легочной артерии (ДЗЛА) является важнейшей гемодинамической характеристикой. В большинстве случаев (хотя и не всегда!) оно соответствует давлению в левом предсердии и конечно-диастолическому давлению в левом желудочке (КДДЛЖ) и отражает, таким образом, состояние легочно-капиллярного кровотока и риск возникновения отека легких у пациентов с левожелудочковой сердечной недостаточностью. Запомните
Давление заклинивания легочной артерии (ДЗЛА) является важнейшей гемодинамической характеристикой. В большинстве случаев (хотя и не всегда!) оно соответствует давлению в левом предсердии и конечно-диастолическому давлению в левом желудочке (КДДЛЖ) и отражает, таким образом, состояние легочно-капиллярного кровотока и риск возникновения отека легких у пациентов с левожелудочковой сердечной недостаточностью.
|
Катетеризация левых отделов сердца. Для катетеризации левых отделов сердца и аорты чаще используют два метода: 1) ретроградную артериальную катетеризацию аорты и левого желудочка и 2) транссептальный доступ. Чаще применяют ретроградный артериальный доступ. В этом случае специальный катетер вводят чрескожно в бедренную артерию или через небольшой разрез в плечевую артерию (рис. 6.50). Введение катетера в аорту и затем в левый желудочек контролируют с помощью рентгенотелеустановки.
Транссептальный доступ обычно используют в тех случаях, когда по каким-то причинам ретроградная артериальная катетеризация оказывается технически сложной, например, из-за выраженного сужения аортального клапана, наличия гипертрофической кардиомиопатии или механического протеза клапана и т.п. Катетер вводят в правую бедренную вену и продвигают его в направлении к сердцу. Когда катетер достигает правого предсердия, через него вводят длинную иглу с закругленным концом, пунктируют ею межпредсердную перегородку в области овального отверстия. После этого катетер вводят по игле в левое предсердие, затем в левый желудочек и, при необходимости, в аорту и регистрируют кривые давления.
Катетеризация правых отделов сердца является в настоящее время хорошо отработанной и практически безопасной процедурой, постановка же артериальных катетеров иногда чревата тяжелыми последствиями и поэтому применение ее ограничено.

|
| Рис. 6.50. Схема ретроградного артериального доступа при катетеризации левых отделов сердца. Катетер введен в бедренную артерию, аорту и левые отделы сердца (ЛЖ и ЛП) |
 Запомните
Катетеризация левых отделов сердца и аорты (в сочетании с постановкой катетера в правые отделы) показана в следующих клинических ситуациях: Запомните
Катетеризация левых отделов сердца и аорты (в сочетании с постановкой катетера в правые отделы) показана в следующих клинических ситуациях:
|
Интерпретация результатов. Катетеризация правых и левых отделов сердца позволяет получить информацию о динамике внутрижелудочкового и внутрипредсердного давления и давления в крупных магистральных сосудах (аорте и легочной артерии). Нормальные величины давления в полостях сердца и магистральных сосудах представлены в табл. 6.10.
Таблица 6.10.
Нормальные величины давления в полостях сердца и магистральных сосудах в покое (мм рт. ст.)
| Камеры сердца и магистральные сосуды | Максимальное систолическое давление | Конечно-диастолическое давление | Среднее давление |
| Правое предсердие | – | – | 4–5 |
| Правый желудочек | 25–30 | 4–6 | – |
| Легочная артерия | 25–30 | 10–12 | – |
| Левое предсердие | – | – | 8–12 |
| Левый желудочек | 120–145 | 10–12 | – |
| Аорта | 120–145 | – |
Как видно из таблицы, в норме систолическое давление в левом желудочке и аорте значительно выше, чем в правом желудочке и легочной артерии, тогда как величины диастолического давления в этих отделах отличаются в меньшей степени.
Особое практическое значение имеет определение конечно-диастолического давления в левом желудочке (КДДЛЖ), величина которого часто используется для характеристики функции левого желудочка. Данные о величине КДДЛЖ можно получить при катетеризации левых отделов сердца. Однако на практике КДДЛЖ чаще оценивают по величине “ давления заклинивания ” легочной артерии (ДЗЛА), что существенно упрощает процедуру исследования, делая не столь необходимой катетеризацию аорты и левого желудочка. В большинстве случаев ДЗЛА и КДДЛЖ почти совпадают. Исключение составляют пациенты с сопутствующим стенозом левого атриовентрикулярного отверстия, у которых повышено ДЗЛА, тогда как КДДЛЖ остается нормальным. Кроме того, КДДЛЖ иногда пытаются оценить по уровню диастолического давления в легочной артерии. Такая оценка возможна только у больных, у которых отсутствуют другие причины повышения давления в легочной артерии, а именно: митральный стеноз, обструктивные заболевания легких, первичная легочная гипертензия и др.
Повышение КДД в левом желудочке является одним из важнейших признаков снижения насосной функции этого отдела сердца —левожелудочковой сердечной недостаточности. Нередко этот признак появляется задолго до уменьшения величины сердечного выброса (МО). При нарушении систолической функции повышение КДД сочетается, как правило, с компенсаторным увеличением конечно-диастолического объема ЛЖ и его дилатацией. Другой важный механизм повышения КДД — увеличение жесткости стенки ЛЖ (снижение ее диастолической податливости), что чаще наблюдается у больных с выраженной гипертрофией миокарда, кардиосклерозом, распространенной ишемией или острым ИМ.
Снижение КДД в левом желудочке у больных ИМ является указанием на наличие гиповолемии, сопровождающейся, как правило, уменьшением конечно-диастолического объема левого желудочка (гиповолемический кардиогенный шок, длительный пароксизм наджелудочковой или желудочковой тахикардии и т.п.).
Определение сердечного выброса. Сердечный выброс — это количество крови, выбрасываемой правым и левым желудочком в единицу времени (1 мин). Наиболее точными методами определения сердечного выброса (или минутного объема крови — МО) являются прямые методы Фика и так называемые методы разведения. Они основаны на следующем принципе (рис. 6.51).

|
| Рис. 6.51. Принцип определения сердечного выброса методом разведения индикатора (а) и классическим методом Фика с вдыханием кислорода (б). Объяснение в тексте. С 1 — концентрация вещества (в том числе кислорода) дистальнее места его введения; С 2 — концентрация вещества проксимальнее места его введения; V л — легочный кровоток (мл/мин); VО 2 поглощение кислорода легкими (мл/мин) |
Для определения объемной скорости кровотока в какую-либо область сосудистого русла вводится известное количество вещества (красители, радиоактивные вещества, охлажденная ниже температуры крови жидкость, газы и т.п.) и измеряется его концентрация в участке, расположенном ниже по ходу кровотока (С1) (рис. 6.51, а). В случае, если это вещество и в норме присутствует в крови (например, кислород), его концентрация измеряется также проксимальнее места введения (С2) (рис. 6.51, б). При этом разность концентраций вещества (С1 — С2) отражает величину объемной скорости кровотока (V).
Согласно принципу, разработанному Фиком, количество введенного вещества, поступившего к месту регистрации с током крови, равно произведению объемной скорости кровотока (V) на разницу концентраций вещества в проксимальной и дистальной точках их определения (С1 — С2):
I = V x (С1 — С2),
где I — количество введенного вещества, V — объемная скорость кровотока; С1 и С2 — концентрации вещества, дистальнее и проксимальнее места введения.
Отсюда, объемную скорость кровотока можно вычислить следующим образом:
V = I / (С1 — С2).
При использовании классического метода Фика с вдыханием кислорода (см. рис. 6.51, б) величина (С1 – С2) представляет собой артериовенозную разницу по кислороду, а при применении методов разведения (рис. 6.51, а), когда С2 равна нулю, значения С1 отражают среднюю концентрацию индикатора в месте регистрации.
Метод Фика. В классическом методе Фика в качестве вещества, вводимого в сосудистое русло, используется кислород, вдыхаемый легкими, потребление которого в 1 мин определяют с помощью спирометра. Для измерения артериовенозной разницы по кислороду (avРО2) используют порции крови, полученные из легочной артерии во время катетеризации правых отделов сердца, и из аорты или крупной артерии при ее пункции или катетеризации (рис. 6.51, б).
Согласно модифицированной формуле:
Vл = VО2 / avРО2,
где Vл — легочный кровоток (мл/мин), VО2 — поглощение О2 легкими (мл/мин); avРО2 — артериовенозная разница по кислороду (мл или об.%).
При этом допускается, что легочный кровоток (Vл) равен количеству крови, выбрасываемому левым желудочком в минуту, т.е. минутному объему (МО).
Для определения газового состава кровь берут гепаринизированным шприцом одновременно из крупной артерии большого круга (или из аорты при ее катетеризации) и из легочной артерии. Содержание кислорода в этих пробах в объемных процентах (об.%) рассчитывают следующим образом:
РО2 (об.%) = Нb (г%) х 1,39 х N (%),
где РО2 — содержание кислорода в пробе (об.%); Нb — концентрация гемоглобина (в г%), 1,39 — константа Гюфнера (каждый грамм гемоглобина связывает 1,39 г кислорода); N — насыщение кислородом (%).
Для расчета артериовенозной разницы по кислороду можно использовать также значения напряжения кислорода в артериальной и венозной крови, измеряемые полярографически.
Получив значения артериовенозной разницы по кислороду и зная потребление О2 в 1 мин. (VО2), рассчитывают сердечный выброс (МО) по формуле:
МО = VО2 / аРО2 - vРО2(л/мин),
где VО2 — потребление О2 легкими (л/мин); аРО2 и vРО2 — содержание кислорода в пробах артериальной и венозной крови соответственно.
Аналогичным способом можно измерить сердечный выброс, используя в качестве индикатора другие газы: СО2, ацетилен, закись азота и др.
Прямой метод Фика является классическим и наиболее точным методом определения сердечного выброса. Несмотря на необходимость проведения сложных и небезопасных для пациента манипуляций, в частности пункции или катетеризации артериального участка системы кровообращения, метод в последние годы достаточно широко применяется в кардиологической практике, преимущественно у больных с осложненным острым инфарктом миокарда.
 Запомните
Показаниями для применения метода Фика у больных острым инфарктом миокарда являются: Запомните
Показаниями для применения метода Фика у больных острым инфарктом миокарда являются:
|
Методы разведения индикаторов. Методы разведения индикаторов являются своеобразной модификацией метода Фика и основаны на быстром одномоментном введении непосредственно в кровеносное русло определенного количества какого-либо индикатора (красителя, радиоактивного вещества, охлажденной жидкости и т.п.) (см. рис. 6.51, а). Концентрацию индикатора определяют в пробах крови, взятых из участков, расположенных ниже по ходу кровотока (С1). Кровь извлекают из артерии (аорты) с постоянной скоростью с помощью автоматических насосов. Для определения концентрации индикатора чаще используют специальные проточные (кюветные) денситометры, через которые пропускают артериальную кровь. Денситометры снабжены источником света и фотоэлектрическим датчиком, измеряющим интенсивность светового потока, проходящего через исследуемую кровь
|
|
|


