 |
Ведение больных после выписки из стационара 3 глава
|
|
|
|
Миоглобин. Очень чувствительным, но малоспецифичным маркером некроза является концентрация миоглобина в крови. Его повышение наблюдается через 2–4 ч после ангинозного приступа и сохраняется в течение 24–48 ч после него. Выход миоглобина из сердечной мышцы и повышение его концентрации в крови происходит еще до формирования очага некроза, т.е. на стадии выраженного ишемического повреждения сердечной мышцы. Следует также помнить, что увеличение концентрации миоглобина в крови может быть обусловлено и другими причинами (кроме инфаркта): болезнями и травмами скелетных мышц, большой физической нагрузкой, алкоголизмом, почечной недостаточностью. Изменение содержания миоглобина при остром ИМ представлено в табл. 6.5 и на рис. 6.22, а.
Таблица 6.5
Изменение содержания миоглобина и тропонинов при остром инфаркте миокарда
| Белок | Начало повышения концентрации, ч | Пик увеличения концентрации, ч | Возвращение к норме, сутки |
| Миоглобин | 2–4 | 4–8 | |
| Тропонин I | 2–6 | 24–48 | 7–14 |
| Тропонин Т | 2–6 | 24–48 | 7–14 |

|
| Рис. 6.22. Динамика концентрации тропонинов и миоглобина (а) и активности некоторых ферментов сыворотки крови (б) при остром инфаркте миокарда. Красным цветом обозначены маркеры некроза, рекомендованные Европейским кардиологическим обществом и ВНОК РФ для лабораторной диагностики инфаркта миокарда (тропонины I и Т, МВ КФК,общая КФК). Пунктиром обозначены верхняя граница нормы и уровень, превышение которого следует расценивать как признак некроза сердечной мышцы («ИМ»). М — кривая концентрации миоглобина, Т — тропонинов |
К сожалению, далеко не все клиники в настоящее время имеют возможность лабораторного определения концентрации тропонинов и миоглобина в крови. Поэтому на практике сохраняет свое значение определение других, менее чувствительных и специфичных, маркеров некроза миокарда. Наиболее ценным из них для диагностики острого ИМ является определение активности нескольких ферментов в сыворотке крови:
|
|
|
- креатинфосфокиназы (КФК), особенно ее МВ-фракции (МВ КФК);
- лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
- аспартатаминотрансферазы (АсАТ).
Основной причиной повышения активности ферментов в сыворотке крови у больных острым ИМ является разрушение миокардиальных клеток и выход (вымывание) высвобождающихся клеточных ферментов в кровь. Динамика активности этих ферментов при остром ИМ представлена в табл. 6.6 и на рис. 6,22, б.
Таблица 6.6
Изменение активности некоторых ферментов при остром инфаркте миокарда
(по И.С. Балаховскому; в модификации)
| Фермент | Начало повышения активности, ч | Пик увеличения активности, ч | Возвращение к норме, сутки |
| МВ-фракция КФК | 4–6 | 12–18 | 2–3 |
| КФК | 6–12 | 3–4 | |
| ЛДГ | 8–10 | 48–72 | 8–14 |
| ЛДГ1 | 8–10 | 24–84 | 10–12 |
| АсАТ | 4–12 | 24–36 | 4–7 |
Креатинфосфокиназа (КФК) и ее фракция МВ КФК. Более специфичным лабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ КФК). Ее активность начинает возрастать уже через 4–6 ч, достигает максимума через 12–18 ч и возвращается к исходным цифрам через 48–72 ч от начала ангинозного приступа. Особое значение придается динамике активности фермента: достоверными признаками острого ИМ считают нарастание активности МВ КФК на 25% в двух пробах, взятых с 4-часовым интервалом или постепенное нарастание активности фермента на протяжении 24 ч. Информативным является повышение активности МВ КФК более 10–13 ЕД/л.
Активность общей КФК при ИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 6.22, б).
|
|
|
Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций:
1. При внутримышечных инъекциях.
2. При тяжелой физической нагрузке.
3. После любого хирургического вмешательства.
4. У больных мышечной дистрофией, полимиозитом, миопатией.
5. При повреждениях скелетных мышц, при травмах, судорожном синдроме, длительной иммобилизации.
6. При инсультах и других повреждениях ткани головного мозга.
7. При гипотиреозе.
8. При пароксизмальных тахиаритмиях.
9. При миокардите.
10. При тромбоэмболии легочной артерии.
11. После проведения коронароангиографии.
12. После электроимпульсной терапии (кардиоверсии) и т.д.
В противоположность этому повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Тем не менее следует помнить, что любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК. В литературе имеются также указания на возможность повышения уровня МВ КФК при тяжелой пароксизмальной тахиаритмии, миокардитах и длительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
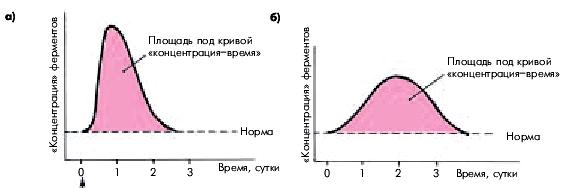
Степень повышения активности МВ КФК в крови в целом хорошо коррелирует с размером ИМ: чем больше объем поражения сердечной мышцы, тем выше активность МВ КФК. Следует, однако, иметь в виду, что в ряде случаев при обширных ИМ вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активности МВ КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том и в другом случае площадь под кривой “концентрация — время” остается одинаковой (рис. 6.23, а, б).
Эти данные послужили основанием для разработки методики неинвазивного определения массы некроза (в граммах) как функции площади под кривой изменения концентрации МВ КФК во времени.
|
|
|
|
| Рис. 6.23. Динамика активности МВ-фракции КФК у двух больных (а, б) с трансмуральным инфарктом миокарда. Площадь под кривой «концентрация–время» одинакова, хотя пиковые значения активности МВ КФК отличаются, что связано с различной скоростью вымывания фермента |
 Запомните
Площадь под кривой “концентрация — время” МВ КФК отражает размеры ИМ, а абсолютные значения активности фермента и время достижения максимума кривой — не только обширность поражения сердечной мышцы, но и скорость вымывания фермента из некротизированного участка сердечной мышцы. Запомните
Площадь под кривой “концентрация — время” МВ КФК отражает размеры ИМ, а абсолютные значения активности фермента и время достижения максимума кривой — не только обширность поражения сердечной мышцы, но и скорость вымывания фермента из некротизированного участка сердечной мышцы.
|
Лактатдегидрогеназа (ЛДГ). Активность этого фермента при остром ИМ нарастает медленнее, чем КФК и МВ КФК, и дольше остается повышенной. Пик активности наступает обычно на 2–3 сутки от начала инфаркта, а возвращение к исходному уровню — только к 8–14 суткам (см. рис. 6.22, б).
Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, тромбоэмболии легочной артерии, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т.д.
В этом отношении изофермент ЛДГ1 более специфичен для поражений сердца, в частности для острого ИМ, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотрансфераза (АсАТ) также относится к числу ферментов с относительно быстро наступающим пиком повышения активности (24–36 ч от начала инфаркта). Через 4–7 суток концентрация АсАТ возвращается к исходному уровню.
Изменение активности АсАТ также не специфично для острого ИМ: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени. Все же следует помнить, что при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца — АсАТ. При ИМ коэффициент Ритиса (отношение АсАТ/АлАТ) больше 1,33, а при заболеваниях печени — меньше 1,33.
|
|
|
Учитывая специфические особенности вымывания различных ферментов из очага некроза и длительность их присутствия в сыворотке крови, необходимо помнить о нескольких принципах ферментативной диагностики острого ИМ.
 Запомните
1. Наиболее чувствительным и специфичным маркером некроза кардиомиоцитов является содержание в крови тропонинов 1 и Т, которое у больных трансмуральным ИМ значительно превышает верхнюю границу нормы, начиная с 2–6 ч после ангинозного приступа и сохраняясь на протяжении 10–14 дней после него. 2. Исследование уровня активности КФК и МВ КФК целесообразно только в течение 1–2 суток, а АсАТ — 4–7 суток от предположительного начала заболевания. 3. Если с момента ангинозного приступа прошло более двух суток, для лабораторного подтверждения ИМ необходимо исследовать в динамике уровень активности ЛДГ, ЛДГ1 и АсАТ вместе с АлАТ и расчетом коэффициента Ритиса. 4. Повышение активности КФК, МВ КФК, ЛДГ, ЛДГ1, АсАТ не является строго специфичным для острого ИМ, хотя при прочих равных условиях активность МВ КФК отличается более высокой информативностью. 5. Отсутствие гиперферментемии не исключает развития ИМ. Запомните
1. Наиболее чувствительным и специфичным маркером некроза кардиомиоцитов является содержание в крови тропонинов 1 и Т, которое у больных трансмуральным ИМ значительно превышает верхнюю границу нормы, начиная с 2–6 ч после ангинозного приступа и сохраняясь на протяжении 10–14 дней после него. 2. Исследование уровня активности КФК и МВ КФК целесообразно только в течение 1–2 суток, а АсАТ — 4–7 суток от предположительного начала заболевания. 3. Если с момента ангинозного приступа прошло более двух суток, для лабораторного подтверждения ИМ необходимо исследовать в динамике уровень активности ЛДГ, ЛДГ1 и АсАТ вместе с АлАТ и расчетом коэффициента Ритиса. 4. Повышение активности КФК, МВ КФК, ЛДГ, ЛДГ1, АсАТ не является строго специфичным для острого ИМ, хотя при прочих равных условиях активность МВ КФК отличается более высокой информативностью. 5. Отсутствие гиперферментемии не исключает развития ИМ.
|
Следует помнить, что окончательная трактовка результатов исследования ферментов и сократительных белков в сыворотке крови при остром ИМ возможна только в комплексе с оценкой клинической картины заболевания, изменений ЭКГ и данных других лабораторных и инструментальных методов исследования.
| 6.4.6. Электрокардиография |

|
Инфаркт миокарда с зубцом Q
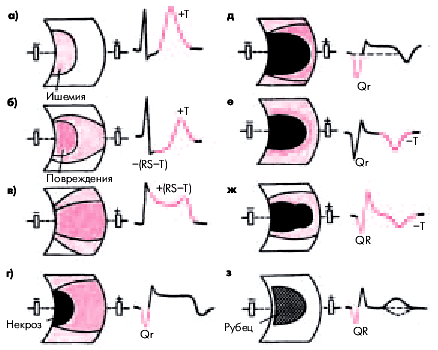
Согласно представлениям Bayley, нарушение коронарного кровообращения при ИМ приводит к формированию трех зон патологических изменений: вокруг участка некроза располагаются зоны ишемического повреждения и ишемии (рис. 6.24). В отведениях, активный электрод которых расположен непосредствено над областью ИМ, каждая из этих зон участвует в формировании следующих ЭКГ-изменений.
1. Зона некроза — патологический зубец Q (продолжительностью больше 30 мс) и резкое уменьшение амплитуды зубца R или комплекс QS.
2. Зона ишемического повреждения — смещение сегмента RS–T выше (при трансмуральном ИМ) или ниже изолинии (при субэндокардиальном поражении сердечной мышцы).
3. Зона ишемии — “коронарный” (равносторонний и остроконечный) зубец Т (высокий положительный при субэндокардиальном ИМ и отрицательный — при трансмуральном ИМ).
| Рис. 6.24. Три зоны патологических изменений в сердечной мышце при остром инфаркте миокарда (по Bayley) и их отражение на ЭКГ (схема) | 
|
ЭКГ изменяется в зависимости от времени, прошедшего от начала формирования ИМ. Динамика ЭКГ в зависимости от стадии инфаркта представлена на рис. 6.25.
|
|
|
|
| Рис. 6.25. Динамика изменений ЭКГ в острой (а–е), подострой (ж) и рубцовой (з) стадиях инфаркта миокарда. Объяснение в тексте |
Острейшая стадия (до 2-х ч от начала ИМ). В течение нескольких минут после прекращения коронарного кровотока и возникновения ангинозного приступа в сердечной мышце обычно выявляется зона субэндокардиальной ишемии, для которой характерно появление высоких коронарных зубцов Т и смещение сегмента RS–Т ниже изоэлектрической линии (рис. 6.25, а, б). На практике эти изменения по понятным причинам регистрируются достаточно редко, и врач, как правило, имеет дело с более поздними электрокардиографическими признаками острейшей стадии ИМ. Когда зона ишемического повреждения распространяется до эпикарда, на ЭКГ фиксируется смещение сегмента RS–Т выше изолинии (трансмуральное ишемическое повреждение). Сегмент RS–Т при этом сливается с положительным зубцом Т, образуя так называемую монофазную кривую, напоминающую по форме ТМПД (рис. 6.25, в).
Острая стадия характеризуется быстрым, в течение 1 — 2 суток, формированием патологического зубца Q или комплекса QS и снижением амплитуды зубца R, что указывает на образование и расширение зоны некроза (рис. 6.25, г, д). Одновременно в течение нескольких дней сохраняется смещение сегмента RS–T выше изолинии и сливающегося с ним вначале положительного, а затем отрицательного зубца Т. Через несколько дней сегмент RS–T приближается к изолинии, а к концу 1-й недели или в начале 2-й недели заболевания становится изоэлектричным, что свидетельствует об уменьшении зоны ишемического повреждения (рис. 6.25, е). Отрицательный коронарный зубец Т резко углубляется и становится симметричным и заостренным (повторная инверсия зубца Т).
В подострой стадии ИМ регистрируется патологический зубец Q или комплекс QS (некроз) и отрицательный коронарный зубец Т (ишемия), амплитуда которого, начиная с 20–25-х суток инфаркта миокарда, постепенно уменьшается. Сегмент RS–T расположен на изолинии (рис. 6.25, ж).
Рубцовая стадия ИМ характеризуется сохранением в течение многих лет патологического зубца Q или комплекса QS и наличием отрицательного, сглаженного или положительного зубца Т (рис. 6.25, з).
Таким образом, прямыми признаками острой стадии ИМ с зубцом Q являются:
- патологический зубец Q (или комплекс QS);
- элевация (подъем) сегмента RS–T и
- отрицательный (коронарный) зубец Т.
В зависимости от локализации ИМ и его распространенности эти изменения обнаруживаются в различных ЭКГ-отведениях (табл. 6.7). Примеры наиболее типичных ЭКГ больных с передним и задним ИМ приведены на рис. 6.26–6.33.
| Рис. 6.26. ЭКГ при переднеперегородочном инфаркте миокарда | 
|
| Рис. 6.27. ЭКГ при переднеперегородочном инфаркте миокарда с переходом на верхушку | 
|
| Рис. 6.28. ЭКГ при переднебоковом инфаркте миокарда | 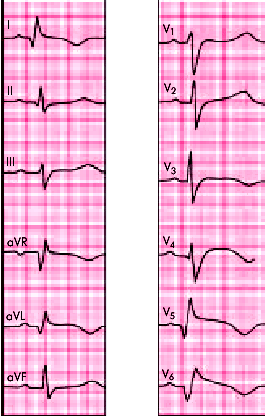
|
| Рис. 6.29. ЭКГ при распространенном переднем инфаркте миокарда | 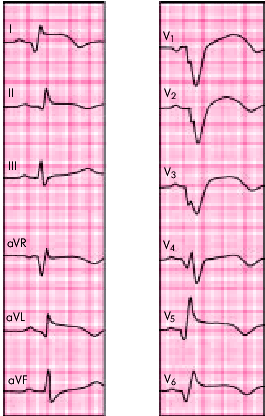
|
| Рис. 6.30. ЭКГ при переднебазальном (высоком переднем) инфаркте миокарда. а — при обычном расположении грудных электродов (инфаркт миокарда не выявляется); б — при расположении электродов на два ребра выше (регистрируются типичные признаки инфаркта миокарда) | 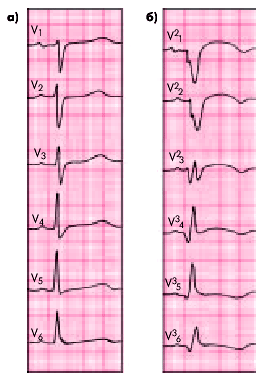
|
| Рис. 6.31. ЭКГ при остром заднедиафрагмальном (нижнем) инфаркте миокарда. В отведениях I, aVL, V1 –V4 регистрируются реципрокные изменения ЭКГ | 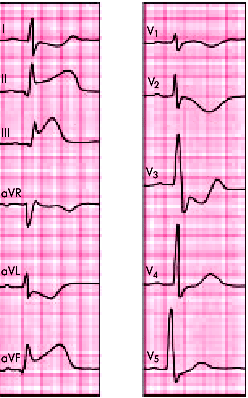
|
| Рис. 6.32. ЭКГ при заднебазальном инфаркте миокарда | 
|
| Рис. 6.33. ЭКГ при заднебоковом инфаркте миокарда | 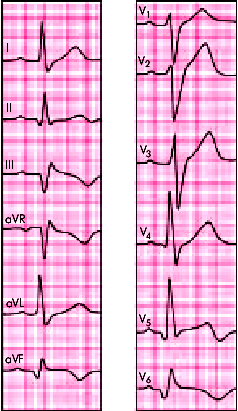
|
Таблица 6.7
Прямые и реципрокные ЭКГ-признаки инфаркта миокарда с зубцом Q различной локализации
| Локализация ИМ | Отведения, в которых обнаруживают признаки ИМ | |
| Прямые признаки: патологический Q (QS); элевация RS–T; отрицательный коронарный Т | Реципрокные признаки: депрессия RS–T; высокий положительный Т; высокий R (при задних ИМ) | |
| Инфаркт миокарда передней стенки ЛЖ | ||
| Переднеперегородочный | V1 — V3 | |
| Передневерхушечный | V3, V4 | |
| Переднебоковой | I, aVL, V5, V6 | |
| Переднебазальный (высокий передний) | V24 — V26 и/или V34 — V36 | |
| Распространенный передний | I, aVL, V1 — V6 | III, aVF, II |
| Инфаркт миокарда задней стенки ЛЖ | ||
| Заднедиафрагмальный (нижний) | III, aVF, II | |
| Заднебазальный | V7 — V9 | V1 — V3 |
| Заднебоковой | V5, V6, III, aVF | |
| Распространенный задний | III, aVF, II, V5, V6, V7 — V9 | V1 — V3 |
Следует подчеркнуть, что диагностика высоких передних ИМ, как правило, возможна только при использовании дополнительных отведений V24 – V26 и/или V34 – V36, электроды которых располагают на 1–2 межреберья выше обычного уровня V4 – V6. При распространенном переднем ИМ в отведениях III и aVF нередко встречаются так называемые реципрокные (“зеркальные”) изменения ЭКГ: депрессия сегмента RS–T и высокий положительный остроконечный и симметричный (коронарный) зубец Т.
При заднебазальном ИМ типичные изменения можно выявить лишь в дополнительных отведениях V7 – V9 (не всегда). Предположение о наличии заднебазального ИМ возникает при регистрации в обычных грудных отведениях V1 – V3 реципрокных изменений ЭКГ: увеличения амплитуды зубцов R, выраженной депрессии сегмента RS–T и формировании высоких положительных зубцов Т. Реципрокные изменения ЭКГ в грудных отведениях V1 – V3 нередко встречаются и при других локализациях ИМ задней стенки ЛЖ (особенно при распространенном заднем ИМ).
Инфаркт миокарда без зубца Q
Инфаркт миокарда без зубца Q характеризуется развитием в сердечной мышце нетрансмуральных очагов некроза, локализующихся субэндокардиально или интрамурально. В отличие от трансмурального ИМ эти очаги некроза не нарушают процесс распространения по сердцу волны деполяризации, поэтому патологический зубец Q или комплекс QS отсутствуют. Значительные нарушения выявляются только в период формирования сегмента RS–T и во время фазы конечной реполяризации желудочков (зубец Т).
Наиболее типичными ЭКГ-признаками ИМ без зубца Q являются:
- смещение сегмента RS–T ниже изолинии (в редких случаях возможна элевация сегмента RS–Т);
- разнообразные патологические изменения зубца Т (чаще отрицательный симметричный и заостренный коронарный зубец Т);
- появление этих изменений на ЭКГ после длительного и интенсивного болевого приступа и их сохранение в течение 2–5 недель.
Диагностика локализации ИМ без зубца Q основана на тех же принципах, что и трансмурального ИМ (см. выше). На рис. 6.34 и 6.35 представлены ЭКГ двух больных с ИМ без зубца Q передней и заднедиафрагмальной локализации.
Следует добавить, что всем больным ИМ, госпитализированным в кардиореанимационное отделение кардиологического стационара проводится постоянный мониторный контроль ЭКГ, ЧСС, уровня АД и некоторых других гемодинамических параметров. С этой целью используют современные системы автоматического мониторного контроля за состоянием сердечно-сосудистой системы, снабженные специальными сигнальными устройствами, срабатывающими при возникновении критических ситуаций и осложнений, например, жизнеопасных нарушений ритма и проводимости.
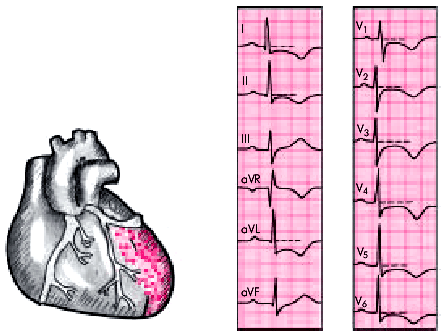
|
| Рис. 6.34. Изменения ЭКГ при нетрансмуральном инфаркте миокарда без зубца Q с локализацией в передней стенке ЛЖ. Заметна выраженная депрессия сегмента RS–Т и отрицательный (коронарный) зубец Т в грудных отведениях и в отведениях I, II, aVL |

| ||
| Рис. 6.35. Изменения ЭКГ при нетрансмуральном инфаркте миокарда без зубца Q с локализацией в заднедиафрагмальной (нижней) стенке ЛЖ. Заметна выраженная депрессия сегмента RS–Т и отрицательный (коронарный) зубец Т в отведениях III, аVF и II; в грудных отведениях — высокие (коронарные) зубцы Т | ||
| 6.4.7. Эхокардиография | ||

| ||
Эхокардиография относится к числу обязательных методов исследования, которые используются для диагностики острого ИМ и оценки гемодинамических и структурных нарушений при этом заболевании. Применение двухмерной, одномерной и допплер-эхокардиографии при ИМ позволяет:
- выявить локальные нарушения сократимости ЛЖ;
- количественно оценить систолическую и диастолическую функции ЛЖ;
- выявить признаки ремоделирования ЛЖ (дилатацию полости желудочка, изменение геометрии ЛЖ и т.д.);
- выявить эхокардиографические признаки аневризмы ЛЖ;
- оценить состояние клапанного аппарата и наличие относительной недостаточности митрального клапана или дефекта МЖП;
- оценить уровень давления в ЛА и выявить признаки легочной гипертензии;
- выявить морфологические изменения перикарда и наличие жидкости в полости перикарда;
- выявить наличие внутрисердечных тромбов;
- оценить морфологические и функциональные изменения магистральных и периферических артерий и вен.
Локальная сократимость левого желудочка. Выявление нарушений локальной сократимости ЛЖ является достаточно надежным способом топической диагностики ИМ с зубцом Q. Признаки гипокинезии, акинезии или дискинезии обнаруживают у 95% больных трансмуральным ИМ и несколько реже при ИМ без зубца Q. В последнем случае обычно выявляется гипокинезия одного или нескольких сегментов ЛЖ. Отсутствие признаков нарушения региональной сократимости ЛЖ практически исключает наличие у больного трансмурального инфаркта миокарда (инфаркта с зубцом Q).
В то же время следует помнить, что причинами локальных нарушений сократимости ЛЖ, помимо острого ИМ, могут быть:
- постинфарктный кардиосклероз (после перенесенного в прошлом ИМ);
- преходящая болевая или безболевая ишемия миокарда ЛЖ, в том числе у больных с хроническими формами ИБС;
- гибернирующий и “оглушенный” миокард (см. выше);
- дилатационная кардиомиопатия (ДКМП);
- гипертрофическая кардиомиопатия (ГКМП) и др.
Поэтому результаты эхокардиографического исследования всегда следует оценивать в динамике, тщательно сопоставляя с клинической картиной заболевания и данными других инструментальных методов исследования.
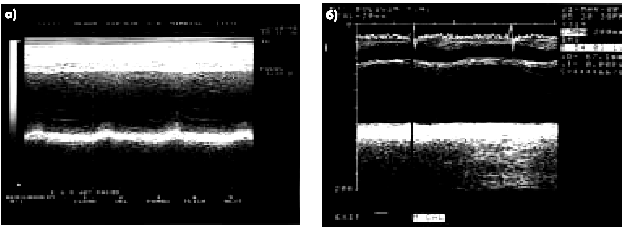
На рис. 6.36 и 6.37 представлены одномерные эхокардиограммы, зарегистрированные у больных ИМ различной локализации, на которых хорошо видны признаки гипокинезии или акинезии пораженных сегментов ЛЖ.

|
| Рис. 6.36. Одномерные эхокардиограммы, зарегистрированные из левого парастернального доступа у здорового человека (а — схема) и у больного постинфарктным кардиосклерозом (б). На рис. 6.36, б заметна гипокинезия межжелудочковой перегородки |
|
| Рис. 6.37. Две одномерные эхокардиограммы, зарегистрированные у больных с постинфарктным кардиосклерозом: а — акинезия межжелудочковой перегородки; б — акинезия заднедиафрагмального (нижнего) сегмента ЛЖ |
Систолическая функцияЛЖ. Эхокардиографическая оценка систолической функции ЛЖ проводится с использованием нескольких методов. Наиболее приемлемыми из них считаются метод дисков (по Simpson), метод “площадь–длина”, а также метод допплер-ЭхоКГ, подробно описанные в главе 2.
Следует помнить, что снижение ФВ до 40% и менее расценивается как один из важных критериев неблагоприятного прогноза ИМ.
Диастолическая функция ЛЖ. Нарушения диастолической функции ЛЖ выявляются практически у всех больных ИМ с зубцом Q и у части пациентов с нетрансмуральным ИМ. В основе диастолической дисфункции ЛЖ при ИМ лежит увеличение ригидности (снижение растяжимости) ишемизированного и некротизированного миокарда желудочка. Оценку диастолической функции ЛЖ проводят с использованием допплерэхокардиографии по методике, описанной ранее (см. главу 2). Изучают отдельные показатели трансмитрального диастолического потока крови. При ИМ часто наблюдаются признаки диастолической дисфункции I типа (тип замедленной релаксации ЛЖ), которая характеризуется снижением скорости изоволюмического расслабления и объема раннего диастолического наполнения (Рeak Е). При этом увеличиваются скорость и объем кровотока во время систолы предсердия (Рeak А). На допплер-кардиограммах трансмитрального кровотока определяются снижение амплитуды пика Е и увеличение высоты пика А (рис. 6.38). Это свидетельствует о том, что бульшая часть диастолического кровотока вследствие нарушения податливости стенки ЛЖ осуществляется во время активной систолы ЛП. Допплер-эхокардиографические признаки диастолической дисфункции ЛЖ при остром ИМ ассоциируются с более высоким риском возникновения застоя крови в малом круге кровообращения.
Мониторирование параметров гемодинамики. Регистрация допплер-эхокардиограмм систолического потока крови в выносящем тракте левого и правого желудочков позволяет неинвазивно определять некоторые важные параметры гемодинамики — величину сердечного выброса, ФВ и уровень давления в легочной артерии (см. главу 2).
Использование метода эхокардиографии для диагностики аневризмы ЛЖ, перикардита, острой недостаточности митрального клапана и других осложнений описано в разделе “Осложнения ИМ” и последующих главах руководства.
| Рис. 6.38. Допплер-эхокардиограмма больного с признаками диастолической дисфункции ЛЖ | 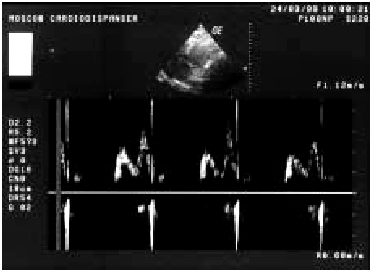
| ||
| 6.4.8. Сцинтиграфия миокарда с 99mТс-пирофосфатом (технецием) | |||

| |||
Сцинтиграфия миокарда с 99mТс-пирофосфатом (технецием)применяется для визуализации очагов инфаркта миокарда, поскольку это радиоактивное вещество избирательно накапливается в некротизированной ткани сердечной мышцы в том случае, если в зоне поражения сохраняется по крайней мере 10–40% кровотока (в том числе коллатерального), необходимого для доставки технеция к очагу некроза.
Сцинтиграммы регистрируют в трех cтандартных проекциях через 90 мин после внутривенного введения индикатора. Это время необходимо для очищения крови от индикатора за счет поглощения его костной и некротизированной тканью. Анализ сцинтиграмм проводят после процедуры накопления импульсов излучения и процедуры вычитания фона.
Очаг острого инфаркта миокарда выявляется с помощью этой методики уже через 24 ч от начала заболевания (рис. 6.39). При обычном течении инфаркта очаг некроза визуализируется вплоть до 8–10 дня болезни. Если же технеций продолжает накапливаться в сердечной мышце на 2–3-й неделе от начала заболевания, это свидетельствует о замедлении репаративных процессов, затяжном течении инфаркта или развитии постинфарктной аневризмы.
|
|
|


