 |
Желаем удачи в выполнении задания!
|
|
|
|
Желаем удачи в выполнении задания!
11 класс Решения
Задание 11-1. «Всем известный минерал» и система оценивания
Решение:
А – карбонат кальцияCaCO3; B– оксид углерода (IV)CO2; С – гидрокарбонат кальцияCa(HCO3)2; D - хлорид кальцияCaCI2; G – оксид кальция CaO; F – гидроксид кальция Ca(OH)2. За каждое вещество 0, 5 балла (всего 3 балла)
1) CaCO3 + CO2 + H2O = Ca(HCO3)2
2) CaCO3 + 2HCI = CO2 + CaCI2 + H2O
3) Ca(HCO3)2 + 2HCI = CaCI2 + 2CO2 + 2H2O
4) CaCO3  CO2 + CaO
CO2 + CaO
5) CaO + H2O = Ca(OH)2
6) Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
7) Ca(OH)2+ CO2= CaCO3+ H2O
За каждое уравнение реакции 1 балл (всего 7 баллов)
Итого: 10 баллов
Задание 11-2. Решение и система оценивания
Решение:
1. С(гр. ) + О2(г) = СО2(г) 1 балл
2. По закону Гесса Δ Н0реакции = Δ Н0(СО2)газ – [Δ Н0(О2) газ + Δ Н0(С)графит)], 2 балла
подставив данные, получим Δ Н0реакции = – 393, 8 кДж/моль. 1 балл
3. Теплота сгорания этой реакции Q = – Δ Н0реакции; Q = 393, 8 кДж/моль. 1 балл
4. Для вычисления теплотворной способности возьмем образец угля массой 1 кг, тогда в нем будет содержаться углерод:
m(С) = ω (С)·m(угля) = 0, 87·1000г = 870г 2балла
5. Рассчитаем ТС угля:
ν (С) = m(С): M(C) = 870г: 12г/моль = 72, 5 моль 1 балл
Q = 393, 8 кДж/моль ·72, 5 моль = 28550, 5 кДж 1 балл
ТС(угля) = 28550, 5 кДж: 1кг = 28550, 5 кДж/кг. 1 балл
Или
ТС(угля) = 393, 8 кДж/моль · (870г: 12г/моль) / 1кг = 28550, 5 кДж/кг. 3 балла
Итого: 10 баллов
Задание 11-3. «Раскрываем загадку металла»
Решение и система оценивания
Согласно уравнению реакции
 , за реакцию –2 балла
, за реакцию –2 балла
где х – степень окисления металла, находим
n(H2) = 4, 48/22, 4 = 0, 2 моль 1 балл,
n(Me) =2 n(H2)/x = 2∙ 0, 2/x = 0, 4/xмоль 2 балла.
MMe = m/n = 11, 2x/0, 4 = 28xг/моль 1 балл.
при х = 1 MMe = 28 г/моль; при х = 2 MMe = 56г/моль; при х = 3 MMe = 168г/моль (за определение молярной массы металла 1 балл).
|
|
|
Следовательно, металлом является железо 1 балл.
Электронная конфигурация валентного энергетического уровня основного состояния железа имеет вид 3d64s2 (2 балла).
Итого – 10 баллов
Задание 11-4. «Разделяем, разделяем…»
Решение и система оценивания
Реактив – подкисленный растворKMnO4.
CH3COONa + KMnO4 → реакция не идет (2 балла)
5H2CO + 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O (3 балла), обесцвечивание раствора и выделение газа (1 балл за пояснение);
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O(3 балла), обесцвечивание, но газ не выделяется (1 балл за пояснение).
Задание 11-5.
Решение и система оценивания
1. При увеличении температуры скорость реакции возрастает 1 балл
2. Скорость химической реакции увеличивается, т. к. при повышении температуры увеличивается число (или доля) молекул, обладающих энергией, достаточной для их взаимодействия.
Для того, чтобы произошла реакция, молекулы должны обладать энергией выше, чем средняя энергии теплового движения молекул. Такие молекулы с повышенной энергией называются активными. 2 балла
- а) Уравнение Аррениуса:
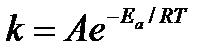 1 балл
1 балл
или

б) Уравнение Вант-Гоффа:  1 балл
1 балл
Уравнение Аррениуса более универсально 1 балл
- По правилу Вант-Гоффа
 2 балла
2 балла
- Из уравнения Аррениуса
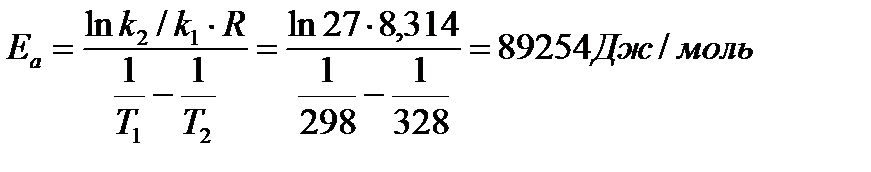 2 балла
2 балла
ИТОГО 10 баллов
11 класс Решения
Задание 11-1. «Всем известный минерал»
Решение:
Газ В – оксид серы (IV) SO2; газ А – сероводород H2S; негашеная известь - CaO
CaO + H2O = Ca(OH)2 образуется раствор гашеной извести Ca(OH)2
|
|
|
2H2S + 3O2 = 2SO2+ 2H2O
n(SO2) = 4, 4, 8/22, 4 = 0, 2 моль
m(NaOH) = 385 ∙ 0, 04 ∙ 1, 04 = 16 г.
n(NaOH) = 16/40 = 0, 4 моль, следовательно получается средняя соль:
2NaOH + SO2 = Na2SO3 + H2O
n(Na2SO3) = n(SO2) = 0, 2 моль.
Na2SO3 + Ca(OH)2 - СaSO3 + 2 NaOH
n(Ca(OH)2) = n(Na2SO3) = 0, 2 моль. Исходя из диссоциации, в 1 литре раствора содержится 0, 1 моль гидроксо–групп [OH-].
[H+] = 10-14/10-1= 10-13
pH = -log[H+] = -log10-13 = 13
Задание 11-1. «Всем известный минерал» (10 баллов)
Какие вещества зашифрованы в предложенных схемах? Подсказки приведены ниже.
1) А + B + Н2О → С
2) А + HCI → B + D +…
3) C + HCI → B + …
4) A  B + G
B + G
5) G + Н2О → F
6) C + F → А + …
7) F + B → А + …
Определите все вещества, назовите их и напишите уравнения химических реакций (уравняв их, если есть необходимость). Подсказка Соединение А, входит в породу, которой Белгород обязан своим названием.
Решение:
Решение:
А – карбонат кальцияCaCO3; B– оксид углерода (IV)CO2; С – гидрокарбонат кальцияCa(HCO3)2; D - хлорид кальцияCaCI2; G – оксид кальция CaO; F – гидроксид кальция Ca(OH)2. За каждое вещество 0, 5 балла (3 балла)
1) CaCO3 + CO2 + H2O = Ca(HCO3)2
2) CaCO3 + 2HCI = CO2 + CaCI2 + H2O
3) Ca(HCO3)2 + 2HCI = CaCI2 + 2CO2 + 2H2O
4) CaCO3  CO2 + CaO
CO2 + CaO
5) CaO + H2O = Ca(OH)2
6) Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
7) Ca(OH)2+ CO2= CaCO3+ H2O
За каждую реакцию – 1 балл. Итого – 10 баллов.
|
|
|


