 |
Рибозимы как лекарственные средства
|
|
|
|
На основании результатов рассмотренных опытов, а также других накопленных знаний о рибозимах складывалось мнение о принципиальной возможности использования рибозимов для регуляции активности конкретных генов человека. Область применения рибозимов как лекарственных средств может быть весьма широкой. В качестве возможных сфер их использования в клиниках в настоящее время рассматривают лечение вирусных инфекций, онкологических заболеваний, для которых известны продукты онкогенов, а также патологических состояний организма, вызываемых сверхэкспрессией конкретных генов.
Лечение вирусных заболеваний. Большие усилия предпринимаются для использования рибозимов в лечении СПИДа, вызываемого вирусами иммунодефицита человека (ВИЧ). Уже в 1990 г. Н. Сарвер и соавторы продемонстрировали возможность расщепления геномной ВИЧ-РНК с помощью рибозима in vitro в бесклеточной системе, что сопровождалось снижением уровня р24-антигена на 98%. Длительные эксперименты на культурах клеток показали, что клетки, экспрессирующие такие рибозимы, не изменяли своего обычного фенотипа на протяжении, по крайней мере, 9 месяцев. Одновременно с этим было показано, что клетки линии MT4, стабильно трансфецированные вектором, экспрессирующим рибозим под контролем промотора гена тимидинкиназы вируса простого герпеса, были частично устойчивы к ВИЧ-инфекции. Полностью устойчивыми к заражению ВИЧ оказались клетки, содержащие рибозим под контролем вирусного регуляторного элемента tar, в которых вирус не обнаруживали даже через 22 дня после заражения. В этих клетках высокий уровень индукции синтеза рибозима происходит как раз во время ВИЧ-инфекции. Та же самая стратегия была применена и к рибозимам, образующим структуру типа шпильки. Экспрессия гена рибозима под контролем промотора гена b-актина подавляла ВИЧ-инфекцию в культивируемых клетках. При этом продукты расщепления ВИЧ-РНК в таких клетках специфически и быстро деградировали.
|
|
|
Еще одним подходом к преодолению ВИЧ-инфекции является отщепление 5’-концевой кэп-структуры ВИЧ-РНК с помощью рибозимов. Известно, что у большинства изолятов ВИЧ 5’-концевая лидерная последовательность их геномной РНК высококонсервативна. Из всех известных изолятов только штамм MN содержит замену одного нуклеотида в лидерной области РНК, расщепляемой рибозимом. В то же время исследованные штаммы ВИЧ различаются по другим участкам 5’-концевой лидерной последовательности. Эндонуклеазное удаление в составе олигонуклеотида 5’-концевой кэп-группы РНК ВИЧ подавляет трансляцию РНК и делает ее более доступной мишенью для внутриклеточных нуклеаз. Все имеющиеся экспериментальные данные позволяют сегодня сделать вывод о перспективности использования 5’-концевой лидерной последовательности ВИЧ-РНК в качестве мишени для рибозимов.
Основной сложностью, которую приходится преодолевать при конструировании рибозимов, расщепляющих геномную ВИЧ-РНК, является высокая мутабильность этих РНК. Из-за мутационных замен отдельных нуклеотидов в сайтах, по которым происходит расщепление РНК рибозимами, последние утрачивают свою активность по отношению к этим РНК и соответственно противовирусную активность. Новейшая стратегия в решении данной проблемы заключается в создании нескольких рибозимов, действие которых направлено против разных консервативных участков генома ВИЧ, причем отдельные рибозимы должны входить в одну молекулу рекомбинантной РНК ("метод дробовика"). Помимо последовательностей антивирусных рибозимов такие рекомбинантные РНК содержат в себе дополнительные cis -действующие рибозимы, которые осуществляют аутокаталитический процессинг предшественников антивирусных рибозимов с освобождением зрелых рибозимов, действующих на разные участки вирусного генома. Этот метод не позволяет вирусу ВИЧ избежать инактивирующего действия рибозимов путем мутационных преобразований своего генома.
|
|
|
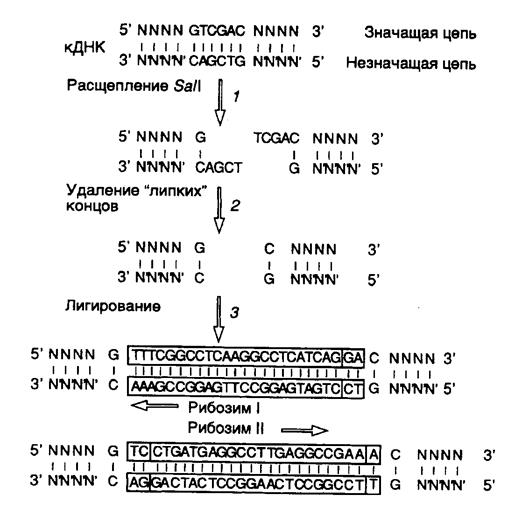
Рис. II.26. Использование сайтов рестрикции для конструирования рибозима, интегрированного в антисмысловую РНК
Недавно была получена кассета из девяти идентичных генов рибозимов, расположенных друг за другом в одном экспрессирующем векторе. Рибозимы такой "полицистронной" РНК, направленные против разных частей ВИЧ-генома, сохраняли внутри клетки свою специфичность, но были более эффективными в пересчете на одну копию РНК полирибозима и не утрачивали своей активности даже в частично деградировавших молекулах РНК.

Рис. II.27. Взаимодействие рибозима с РНК-субстратом
В заключение этого раздела рассмотрим пример использования рибозимов против вирусов растений в сельском хозяйстве. Как упоминалось выше, рибозимы, образующие структуру типа "головки молотка", распознают в сайте расщепления РНК-мишени последовательности из трех нуклеотидов, рядом с которой происходит гидролиз цепи РНК. Подобными тринуклеотидами могут быть последовательности AUC, CUA, CUC, GUA, GUC, GUU и UUC. В предложенном подходе РНК-связывающий домен рибозима конструируют таким образом, что распознаваемый тринуклеотид входит в состав последовательности нуклеотидов, которая в двухцепочечной ДНК образует сайт рестрикции. Подобный подход дает возможность встраивать последовательность каталитического домена рибозима по этому сайту рестрикции в кДНК, полученную путем обратной транскрипции РНК-мишени. Следовательно, каталитический домен рибозима оказывается фланкированным последовательностями антисмысловой РНК, комплементарной РНК-мишени, которые автоматически выполняют роль РНК-связывающего домена. При таком подходе отпадает необходимость в синтезе большого числа олигонуклеотидов, и в любом необходимом случае рибозим собирается из готовых блоков. В качестве конкретного примера рассмотрим создание рекомбинантного рибозима, специфически расщепляющего РНК, содержащую последовательность сайта рестрикции Sal I (рис. II.26). После расщепления кДНК рестриктазой Sal I (этап 1) образовавшиеся "липкие" концы гидролизуют нуклеазой S1 (этап 2) и по образовавшимся "тупым" концам встраивают каталитический домен рибозима, заключенный в двухцепочечном фрагменте ДНК (этап 3). В результате транскрибирования такой конструкции синтезируется антисмысловая РНК, в состав которой включен каталитический домен рибозима. После гибридизации с РНК-мишенью образуется двухцепочечная молекула РНК, на одной из цепей которой формируется структура рибозима типа "головки молотка" (рис. II.27), расщепляющего РНК-мишень в строго определенном месте. Описанный подход был реализован при конструировании рибозима, направленного против геномной РНК одного из вирусов сливы. При этом были получены последовательности нуклеотидов рибозима, пригодные для использования с другими 25 сайтами рестрикции.
|
|
|
Подавление функционирования онкогенов. Одними из основных различий, обнаруживаемых между нормальными и раковыми клетками, являются генетические различия ряда генов, контролирующих пролиферацию. В геноме опухолевых клеток часто обнаруживают мутации в генах двух типов: онкогенах и генах-супрессорах опухолевого роста, или антионкогенах. Онкогены эволюционно консервативны и вызывают неопластическую трансформацию клеток как при ретровирусной инфекции в природных условиях (поскольку они часто бывают включены в состав генома ретровирусов), так и после введения ДНК онкогенов в культивируемые клетки с помощью трансфекции. Большинство онкогенов вначале было обнаружено именно в составе генома онкогенных вирусов, и они являются мутантными производными протоонкогенов, присутствующих в здоровых клетках многоклеточных организмов и активирующихся во время эмбриогенеза, роста клеток или регенерации тканей. Поскольку активированные онкогены в опухолевых клетках, как правило, сверхэкспрессируются и кодируемая ими РНК по своей первичной структуре отличается от РНК протоонкогенов, РНК онкогенов являются хорошей потенциальной мишенью для рибозимов.
|
|
|
Онкоген H-ras. Мутация в кодоне 12 гена H -ras, приводящая к замене GGC®GUC, создает консенсусный сайт, по которому HH-рибозим может расщеплять мутантную мРНК. In vitro было продемонстрировано пятикратное различие в эффективности действия рибозима на мутантную H -ras -РНК и соответствующую РНК дикого типа. Получены H -ras -зависимые линии клеток, стабильно трансформированные экспрессирующим вектором, который направлял синтез HH-рибозима под контролем промотора b-актинового гена. Для таких клеток характерна пониженная скорость пролиферации, сопряженная с уменьшением внутриклеточных уровней H -ras -РНК и белка р21, кодируемого этим геном. Далее рибозим экспрессировали в клетках линии EJ карциномы мочевого пузыря человека. Введение исходных клеток мышам сопровождалось их быстрой гибелью на фоне развития высокоинвазивных опухолей. В отличие от этого клоны EJ-клеток, экспрессирующих рибозим, в организме мышей обладали резко сниженным опухолевым фенотипом. Образующиеся опухоли были малоинвазивны, и наблюдалось приблизительно двукратное повышение уровня выживаемости мышей с трансплантатами. Гистологические исследования подтверждали слабую способность опухолей к метастазированию. Рибозимы в опухолях обнаруживались методом ПЦР на протяжении 86–90 дней. Таким образом, эти и ряд других экспериментов показали способность рибозимов нормализовать экспрессию активированного H -ras как in vitro, так и in vivo.
Онкоген c-fos. Как уже упоминалось в первой части книги, белковый продукт гена c-fos участвует в передаче сигнала эукариотическими клетками, вовлечен в синтез ДНК и может придавать клеткам устойчивость к противоопухолевым препаратам. Последние два свойства этого белка находят подтверждение, в частности в том факте, что при проведении лечения часто используемым противоопухолевым лекарством цисплатином (цис- диаминодихлорплатина) происходит индукция гена c-fos вслед за генами dTMP-синтазы и ДНК-полимеразы. Рибозим, разрушающий c-fos -мРНК, снижал конечный уровень экспрессии гена c-fos, приводил к повышению чувствительности опухолевых клеток к химиотерапевтическим агентам (включая цис- платину) и значительно подавлял экспрессию генов dTMP-синтазы, ДНК-полимеразы b и гена металлотионеина человека hMTII-A.
Онкогены bcr/abl. Аберрантная филадельфийская хромосома образуется в результате транслокации (9;22)(q34;q11) в стволовых клетках костного мозга, что сопровождается слиянием генов bcr и abl с образованием химерного онкогена bcr/abl и развитием хронических миелоидных лейкозов (ХМЛ). Транскрипт химерного гена кодирует белок р210bcr/abl, который обладает повышенной активностью тирозинкиназы. Такие РНК и белок обнаруживаются почти у всех больных с синдромом ХМЛ, а также у 50% пациентов с острым лимфобластоидным лейкозом, у которых имеется филадельфийская хромосома. С помощью рибозимов, специфически расщепляющих последовательность химерной мРНК в месте стыковки последовательностей двух генов, удалось подавить экспрессию химерного гена bcr/abl в культивируемых клетках. Экспрессия рибозимов в культивируемых клетках вызывала снижение уровня bcr/abl -мРНК, полностью блокировала образование химерного белка р210bcr/abl и ингибировала рост клеток на 84%. Эти результаты были значительно лучше эффектов, вызываемых антисмысловыми олигонуклеотидами.
|
|
|
В работах других исследователей был получен рибозим, расщепляющий вышеупомянутую химерную РНК по кодону GUU, расположенному по соседству с местом стыковки последовательностей двух генов. Этот рибозим разрушал соответствующую РНК in vitroиin vivo, а также подавлял тирозинкиназную активность белка р210.
9.2.4. Репарация мутантных РНК с помощью рибозимов, осуществляющих транс- сплайсинг
Просто устроенные HH- и HP-рибозимы принято рассматривать как рибозимы первого поколения. Во всех примерах, рассмотренных выше, в прикладных целях использовалась их способность осуществлять специфическое эндонуклеазное расщепление молекул РНК. Недавно (Дж. Т. Джонс и др., 1996 г.) удалось приспособить рибозимы для восстановления генетической информации на уровне молекул РНК, структура которых нарушена мутациями. Рибозим интрона группы I Tetrahymena после незначительных генно-инженерных модификаций оказался способным выполнять такие репарирующие функции.
Как уже обсуждалось в первой части книги (см. раздел 2.2.3), аутосплайсинг транскриптов, содержащих интроны группы I, начинается с расщепления фосфодиэфирной связи между 5’-концевым экзоном и прилегающим к нему интроном, сопровождаемого полным удалением интрона и лигированием фланкирующих его экзонов, приводящим к восстановлению непрерывной структуры РНК. Идея, лежащая в основе использования рибозимов для репарации РНК, проста. Достаточно лишь с помощью генно-инженерных методов к 3’-концу рибозима присоединить вместо 3’-концевого экзона любую другую последовательность, чтобы она соединялась с последовательностью 5’-концевого экзона в строго определенной точке с образованием гибридной молекулы РНК. Поскольку сайт взаимодействия рибозима с РНК во время транс- сплайсинга и положение точки разрыва РНК целиком определяются внутренней направляющей последовательностью рибозима (internal guide sequence – IGS), присоединение новой 3’-концевой последовательности можно осуществлять практически в любом месте РНК-мишени (рис. II.28). Таким образом, для репарации мутационного повреждения в экзоне 2 на уровне РНК IGS делают комплементарной участку РНК-мишени, локализованному выше точки повреждения (в рассматриваемом примере – А) на стыке экзонов 1 и 2. Экзон 2 дикого типа соединяют с рибозимом, который после взаимодействия с РНК-мишенью вырезает из нее мутантную последовательность экзона 2 и заменяет на эквивалентную последовательность дикого типа. В результате комплекс рибозима и репарированной РНК распадается и обновленная РНК вовлекается в трансляцию.
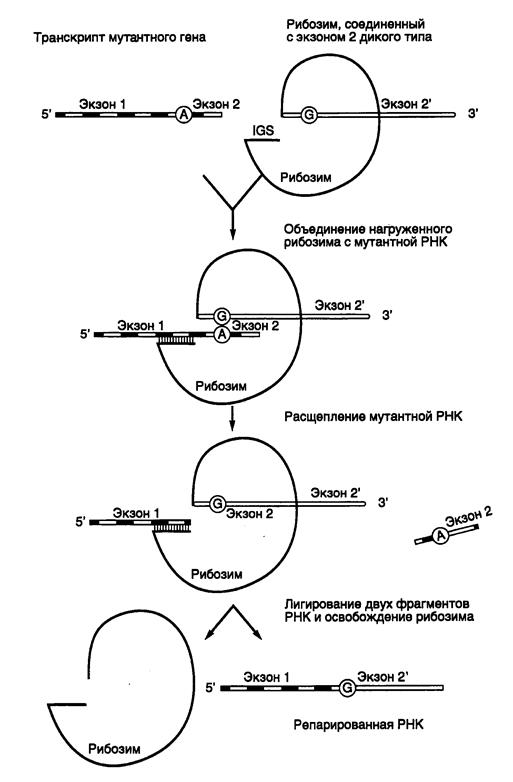
Рис. II.28. Схема репарации мутантной мРНК рибозимом, осуществляющим транс- сплайсинг
Молекула рибозима, соединенная 3’-концом с последовательностью экзона 2 дикого типа, взаимодействует с мутантной РНК выше мутантного нуклеотида и замещает мутантную часть репарируемой РНК в реакции аутосплайсинга
Такой подход был успешно использован для репарации мРНК гена lacZ как в клетках E. coli, так и в культивируемых клетках животных. Точность транс- сплайсинга, направляемого рибозимом, оказалась абсолютной – в образующихся восстановленных молекулах РНК не наблюдали сдвига рамки считывания. Однако в этих опытах на первый план вышла другая проблема. Длина IGS-последовательности, определяющей специфичность взаимодействия рибозима с РНК, составляет всего шесть нуклеотидов. Такая последовательность из шести нуклеотидов в молекулах РНК встречается достаточно часто (каждые 4096 оснований). Следствием этого было объединение репарирующего фрагмента РНК не только с РНК-мишенью, но и другими РНК, не имеющими отношения к первой. Выход из сложившейся ситуации ищут в увеличении специфичности действия рибозима путем удлинения IGS. Однако с увеличением длины области комплементарного взаимодействия между рибозимом и РНК будут возрастать прочность этого взаимодействия и, как следствие, затруднение последующего распада каталитического комплекса, что должно сопровождаться ингибированием реакции.
Применение рибозимов в реакциях транс- сплайсинга для корректировки экспрессии мутантных генов на посттранскрипционном уровне рассматривается как весьма перспективное направление в генотерапии. И хотя более логичной все-таки кажется необходимость репарации мутаций на уровне самих генов, такой подход, возможно, получит право на жизнь и в клиниках. По сути дела он является прототипом реакции редактирования РНК (см. раздел 2.2.2), который эффективно используется клетками при экспрессии ряда генов в природных условиях.
Благодаря генной инженерии введение в молекулярную генетику антисмысловых РНК и рибозимов привело к появлению высокоспецифичного инструмента для изучения функциональной роли и регуляции экспрессии индивидуальных генов in vivo. Использование этих методов представляется особенно перспективным в исследованиях по биологии и генетике развития, так как именно здесь инактивация отдельных генов соматических клеток представляется особенно сложной задачей. Плодотворным подходом является объединение последовательностей антисмысловых РНК с рибозимами, поскольку в результате получаются каталитически действующие, высокоспецифические супрессоры генов, а также конструкции, корректирующие экспрессию генов на посттранскрипционном уровне. Полагают, что дальнейшее развитие техники адресной доставки генов антисмысловых РНК, направленных против патогенных вирусов, в клетки зародышевой линии животных и растений может привести к созданию сортов растений и пород животных, устойчивых к действию патогенных вирусов, и дать большой экономический эффект в сельском хозяйстве. Однако хорошо известно, что на любое лекарство у возбудителя заболевания всегда находится адекватный защитный ответ. Поэтому до тех пор, пока генотерапия не будет опираться на самонастраивающиеся генетические системы, что имеет место, например в случае иммунной системы, победа, в конечном счете, будет оставаться за возбудителем. Нельзя не учитывать и возможное использование антисмысловых РНК в будущем для генотерапии как инструмента воздействия на онкогены и другие генные локусы, повышенный уровень экспрессии которых вредно сказывается на жизнедеятельности соматических клеток многоклеточных организмов. Первые результаты, полученные при разработке некоторых из этих направлений молекулярной генетики, кратко изложены в главе 11.
Дезоксирибозимы
В отличие от РНК, выполняющих в клетке разнообразные функции, благодаря возможностям формирования у этих макромолекул сложных пространственных структур, для внутриклеточных ДНК пока известна единственная функция – пассивное хранение генетической информации. Отчетливо различающиеся биохимические функции биополимеров этих двух видов объясняют исключительно особенностями их химического состава. Отсутствие у ДНК в 2'-положении рибозы гидроксильной группы делает ее более устойчивой к расщеплению in vivo, а следовательно, более приемлемым, чем РНК, носителем генетической информации. Наличие же у РНК 2'-OH-группы, напротив, является предпосылкой ее структурной и функциональной сложности.
Несмотря на прогноз о большой каталитической инертности ДНК, в течение последних пяти лет ферментативная активность была обнаружена и у ее молекул, правда пока только в искусственных условиях. Молекулы ДНК, обладающие ферментативной активностью, получили название дезоксирибозимов. К настоящему времени описана способность дезоксирибозимов расщеплять, лигировать и фосфорилировать молекулы ДНК, метилировать порфирины или осуществлять гидролиз РНК. Получены дезоксирибозимы с активностями РНКазы, которые используют в качестве кофакторов аминокислоты, ионы металлов, а также не требуют кофакторов вообще. При этом Mg2+-зависимые дезоксирибозимы расщепляют РНК со скоростью, сопоставимой с таковой природных рибозимов (k кат= 10 мин-1).
Поиск молекул ДНК, обладающих определенными ферментативными активностями, как правило, осуществляется с применением скрининга пула молекул со случайной первичной структурой. Результативность таких исследований во многом зависит от эффективности системы скрининга. Так, при отборе дезоксирибозимов с полинуклеотидкиназной активностью И. Ли и Р.Р. Брикер (1999 г.) использовали пул из 1015 различных молекул синтетических одноцепочечных ДНК длиной в 100 нуклеотидов со случайной 70-нуклеотидной последовательностью в центральной части. Из пула отбирали молекулы, способные фосфорилировать свой 5'-конец в присутствии различных рибо- или дезоксирибонуклеозидтрифосфатов. Наличие 5'-концевого фосфата обнаруживали по приобретению олигонуклеотидами способности участвовать в реакции лигирования с акцепторным олигонуклеотидом на одноцепочечной матрице, стыкующей их концы, поскольку только фосфорилированные молекулы ДНК могли лигироваться с акцепторной ДНК. Молекулы ДНК, длина которых увеличивалась в результате лигирования, очищали электрофорезом, амплифицировали и использовали в новых раундах скрининга. В итоге из смеси молекул ДНК были выделены олигонуклеотиды, фосфорилирующие свой 5'-концевой нуклеотид с использованием γ-фосфатной группы рибо- и дезоксирибонуклеотидов. Некоторые олигонуклеотиды оказались высокоспецифичными в отношении доноров фосфатных групп и работали только в присутствии конкретных нуклеотидов, тогда как другие были неразборчивы в отношении индивидуальных донорных нуклеотидов. Более того, структурные исследования показали, что полученные молекулы ДНК обладают достаточной сложностью, чтобы делать выбор между различными молекулами субстратов, кофакторов и эффекторов.
На основании такого рода данных были сделаны выводы, что молекулы ДНК, как и РНК, способны формировать различные третичные структуры, необходимые для осуществления химического катализа. В будущем они могут быть использованы для конструирования различных дезоксирибозимов. При этом не исключается, что дезоксирибозимы могут быть обнаружены и in vivo.
Аптамеры
Аптамерами называют небольшие молекулы нуклеиновых кислот, которые могут выполнять функции высокоспецифичных рецепторов низкомолекулярных органических соединений. Олигонуклеотидные аптамеры с требуемыми свойствами выделяют из библиотек случайных последовательностей методами селекции in vitro, используя их способность специфически взаимодействовать с соответствующими иммобилизованными лигандами. Такие соединения находят применение в фундаментальных исследованиях молекулярных механизмов взаимодействия нуклеиновых кислот с лигандами, и их начинают использовать для обнаружения повреждений в ДНК, для воздействия на экспрессию генов, а также в качестве модулей при конструировании рибозимов, обладающих аллостерическими свойствами. В настоящее время получены аптамеры как рибо-, так и дезоксирибонуклеотидной природы, которые образуют специфические комплексы с разнообразными химическими соединениями, включая большинство аминокислот, нуклеотиды и их производные, антибиотики, биологически активные пептиды, органические красители, дофамин, теофиллин, и многие другие органические соединения, имеющие биологическое значение. Приведем несколько примеров, иллюстрирующих последние достижения в этой области исследований.
Аптамеры, взаимодействующие с красителями. Недавно была реализована идея использования аптамеров для введения флуоресцентной метки в молекулы РНК, синтезируемые in vivo, для наблюдения за экспрессией соответствующих генов. Из пула случайных последовательностей были выделены ~60-звенные олигорибонуклеотиды, специфически взаимодействующие с сульфородамином B. После введения в аптамеры мутаций и повторной селекции удалось получить олигонуклеотиды, взаимодействующие с флуоресцеином. В иммобилизованном состоянии эти аптамеры специфически связывали флуоресцентные красители и не давали перекрестных реакций.
В другой серии исследований были идентифицированы аптамеры, взаимодействующие с красителем Hoechst H33258, которые функционировали как in vitro, так и in vivo. Последовательности аптамеров в форме кДНК встраивали в виде тандемных повторов в нетранслируемую область гена ß-галактозидазы, находящегося в составе экспрессирующего вектора. Вектор вводили с помощью трансфекции в клетки линии CHO, которые далее выращивали в присутствии красителя. При определении активности ß-галактозидазы через 24 ч после трансфекции установили, что ее синтез не происходил если Hoechst H33258 присутствовал в питательной среде в концентрации 5–10 мM.
Аптамеры, взаимодействующие с небольшими молекулами биологического происхождения. В качестве первого этапа серии исследований по созданию аптамеров, которые бы специфически распознавали олигосахариды поверхности клеток, недавно (1998 г.) были получены олигодезоксирибонуклеотиды, специфичные в отношении дисахарида целлобиозы. Для скрининга аптамеров использовали простую и эффективную методику. Библиотеку олигонуклеотидов инкубировали с целлюлозой, цепи молекул которой построены из целлобиозы, и несвязавшиеся олигонуклеотиды отмывали буферным раствором, а оставшиеся в комплексе – элюировали раствором целлобиозы. Оказалось, что полученные аптамеры специфически распознают целлобиозу как в растворе, так и в составе целлюлозы (Kd = 10–0,1 мкM) и не взаимодействуют с родственными дисахаридами: мальтозой, лактозой и гентиобиозой. Такие результаты создают предпосылки для получения полного набора олигонуклеотидных рецепторов, который можно было бы использовать в технологии микроматриц ДНК для идентификации антигенов поверхности клеток, что весьма актуально, в частности для осуществления пересадки органов и тканей.
Другим впечатляющим результатом этого направления исследований было недавнее получение аптамеров, которые обладали в 1000 раз большим сродством к N-7- метилгуанозину (основному компоненту кэп-групп мРНК эукариот), чем к его неметилированному аналогу. Такие аптамеры специфически ингибировали трансляцию мРНК, содержащих кэп-группы, в бесклеточных системах, полученных из клеток HeLa или дрожжей. Полагают, что такие аптамеры найдут применение в исследовании кэп-зависимых процессов метаболизма эукариотических мРНК, например сплайсинга пре-мРНК или их транспорта из ядра в цитоплазму.
С помощью аптамеров, специфичных в отношении 7,8-дигидро-8-гидрокси-2'-дезоксигуанозина, который возникает при повреждении ДНК радикалами кислорода, удавалось обнаруживать в ДНК одну такую молекулу среди 104 обычных остатков дезоксигуанозина. Аналогичные аптамеры могут быть потенциально использованы для мониторинга мутагенных последствий окислительного стресса в эукариотических клетках.
Перспективы использования аптамеров. Новейшие результаты, полученные с использованием аптамеров, указывают на возможность их применения в ближайшем будущем в биотехнологии для регулируемой экспрессии генов, а также для диагностики и терапии. Одним из наиболее интересных достижений в этой области исследований является создание рибозимов с аллостерическими свойствами. В таких конструкциях каталитический домен рибозима соединяют с последовательностями аптамеров-рецепторов, взаимодействующих с регуляторными молекулами. В присутствии низкомолекулярных регуляторов может происходить специфическая активация или ингибирование ферментативной активности рибозима. Такие гибридные конструкции получили название аптазимов. Недавно полученный аптазим, обладающий РНК-лигазной активностью, активировался в 105 раз в присутствии специфических низкомолекулярных эффекторов. При аналогичном подходе были сконструированы ATP-зависимые рибозимы.
Исключительно важные результаты могут быть получены при скрининге in vitro аптамеров среди пула фрагментов природных РНК. В этом случае библиотеки природных последовательностей могут быть использованы для поиска доменов нуклеиновых кислот, специфически взаимодействующих с известными молекулами биогенного происхождения, например белками ретровирусов, для которых неизвестны РНК-мишени клетки-хозяина. Не исключено, что в ходе такого рода исследований у РНК или их фрагментов будут обнаружены новые внутриклеточные функции, связанные с метаболизмом важных биологических кофакторов, включая ATP, GTP, FAD и NAD+.
|
|
|


