 |
Периодическая система элементов состоит из периодов и групп
|
|
|
|
Предмет и задачи химии. Значение химии.
Химия – наука, изучающая вещества, процессы и законы их превращения сопровождающие изменением состава и строения химических веществ.
Значение химии:
1) Быт
2) Транспорт
3) Топливо
4) Разработка новых источников энергии и топлива
5) Ядерный синтез
6) Промышленность
7) Строительство
8) Разработка методов очистки биосферы и утилизации отходов
9) Сбережение исчерпаемых ресурсов
10) Создание новых медицинских препаратов и лекарств
Строение атома. Модели атома (Морозова, Резерфорда, Бора). Теория бора. Уравнение Планка. Принцип неопределенности Гейзенберга. Волновая функция. Уравнение Шредингера.
Атом состоит из ядра и электронов.
Модели атома:
1) Модель Морозова: атом представлен в форме куба, внутри которого находится положительный заряд, в узлах — отрицательный.
2) Модель Резерфорда: атом, состоит из тяжелого ядра, вокруг которого двигаются по орбиталям электроны, подобно планетам солнечной системы.
3) Модель Бора: атом состоит из тяжелого ядра, вокруг которого двигаются электроны не по любым, а лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер n(1, 2, 3, 4,...), который назвали главным квантовым числом.
Постулаты Бора:
1) ℮ может вращаться вокруг ядра не по любым, а только по конкретным круговым орбитам. Эти орбиты получили название стационарные.
2) двигаясь по стационарной орбите, ℮ не излучает электромагнитной энергии.
3) излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состоянии. Т.е. энергия электрона, вращающегося вокруг ядра, зависит от радиуса орбиты.
|
|
|
Уравнение Планка: E=hν
Принцип неопределенности Гейзенберга: невозможно одновременно точно определить местоположение частицы и его импульс.
Для описания свойств электрона используют волновую функцию, которую обозначают буквой ψ (пси). Квадрат ее модуля |ψ|2, вычисленный для определенного момента времени и определенной точки пространства, пропорционален вероятности обнаружить частицу в этой точке в указанное время. Величину |ψ|2 называют плотностью вероятности. Наглядное представление о распределении электронной плотности атома дает функция радиального распределения.
Уравнение Шредингера: математическое описание поведение электрона в атоме.
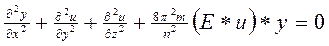
Квантово-механические представления о строении атома. Квантовые числа и их физический смысл.
Распределение ℮ по энергии и в пространстве атома водорода определяется волновой функцией, зависящей от сферических координат ℮ и от трех параметров (n, e, me), принимающих целочисленные значения.
- Главное квинтовое число – n, характеризует энергию орбитали и ее размер n=1,2,…∞, n=N периода.
- Орбитальное квантовое число (побочное) – l, характеризует форму орбитали s,p,d,f. l =0, до n-1
- Магнитное главное квантовое число – m, характеризует направленность орбитали в пространстве: m=-℮..,0,..+℮
- Спиновое квантовое число – s, характеризует вращение ℮ вокруг своей оси: s=+½ и s= ½.
Распределение электронов в многоэлектронном атоме. Принцип Паули. Правило Гунда. Порядок заполнения электронных подуровней.
Распределения электронов в многоэлектронных атомах основано на трех положениях: принципе минимума энергии, принципе В. Паули, и правиле В. Хунда
|
|
|
Принцип минимума энергии: электрон в первую очередь располагается в пределах электронной подоболочки с наинизшей энергией.
Правила Клечковского:
а) электрон обладает наинизшей энергией на той электронной подоболочке, где сумма квантовых чисел n и l минимальна.
б) электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа.
Принцип Паули: в атоме не может быть двух ℮, характ. одинаковым набором всех квант. чисел.
Правило Хунда: min энергия атома соответствует такое распределение ℮ по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома max.
Состояния атома с меньшим, по сравнению с максимальным, значениями суммарного спина электронов будут энергетически менее выгодными и, в отличие от первого, называемого основным, будут относится к возбужденным состояниям.
Периодический закон и Периодическая система Менделеева. s-,p-,d-,f- элементы. Периодичность изменения свойств элементов: относительная электроотрицательность, потенциал ионизации, сродство к электрону, радиус атома, восстановительная и окислительная способность элементов.
Периодический закон Д.И. Менделеева:
строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра и определяются периодически повторяющимися однотипными электронным конфигурациями их атомов.
Периодическая система элементов состоит из периодов и групп
Период – это совокупность элементов с одинаковым значением энергии.
Группа – вертикальный ряд элементов имеющих одинаковое число электронов на внешнем эл. слое.
Заряд ядра равен порядковому номеру элемента в системе. Элементы образуют 7 периодов. В периодах свойства элементов закономерно изменяются при переходе от щелочных металлов к благородным газам. Вертикальные столбцы это группы элементов сходных по свойствам. Внутри групп свойства элементов также изменяются закономерно (например, возрастает химическая активность) Элементы с 58 по 71, а также 90 – 103 образуют 2 семейства – лантаноиды и актиноиды. Периодичность свойств элементов обусловлено периодическим повторением конфигурации внешних электронных оболочек атомов. С положением элементов в системе связаны его химические и многие физические свойства.
|
|
|
Первые три периода называются малыми или короткими все остальные большие или длинные. В зависимости от того, как представлены в периодической таблице длинные периоды, различаются короткопериодные и длиннопериодные варианты таблицы. В последнем варианте длинный период вытянут полностью слева направо и четвертая, пятая строки таблицы содержат последовательность из 18 элементов. Шестой период и теоретически седьмой содержат по 32 элемента.
Длина периода зависит от числа электронов на внешних электронных оболочках атомов элементов. В короткопериодном варианте периодической таблицы длинные периоды разделяют на две части и элементы размешают в те же группы что и элементы коротких периодов, причем так чтобы в каждой клетке было по 2 элемента. Группу элементов делят на главную и побочную при этом под каждым элементом находится по возможности элементы с похожими свойствами, например такие элементы как водород, литий, натрий, калий составляют главную подгруппу элементов, а входящие в медь, серебро, золото образуют побочную подгруппу.
Экспериментальное изучение электронных конфигураций атомов и положения атомов в периодической системе позволяет сделать ряд выводов, придающих физический смысл номеру периода, группы и типу подгруппы и существенно облегчающих запись электронных конфигураций атомов. Среди таких выводов:
1. Номер периода совпадает с
—количеством заполняющихся электронных оболочек атома;
—главным квантовым числом внешней, заполняющейся электронами, оболочки;
—главным квантовым числом, заполняющейся s-подоболочки;
—главным квантовым числом, заполняющейся р-подоболочки;
—главным квантовым числом +1 заполняющейся d-подоболочки (в больших периодах);
—главным квантовым числом +2 заполняющейся f -подоболочки (в 6-м и 7-м периодах).
2. Каждый период начинается двумя s-элементами и, кроме 1-го, заканчивается шестью р-элементами. В 7-м периоде р-элементов нет, так как период не достроен. В больших периодах между s- и р-элементами размещаются десять d-элементов. В 6-м и 7-м периодах за первыми d -элементами (La и Ас) находятся 14 f -элементов.
|
|
|
3. У атомов элементов главных подгрупп на внешней электронной оболочке находится число электронов, численно совпадающее с номером группы.
4. У большинства атомов элементов побочных подгрупп на внешней оболочке находится 2 электрона, у атомов Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au — по 1-му электрону, а атом Pd — не имеет электронов на внешней s-подоболочке.
Энергия ионизации атома – это кол-во энергии, которой необходимо для отрыва или удаления ℮ от невозбужденного атома э0-℮→э+
Энергия необходимая для удаления 1 моля электронов от одного моля атомов какого-либо элемента называется первой энергией ионизации. Характеризует восстановительную способность элементов. Первая энергия определяется электронным строением элементов, и ее изменение имеет периодический характер. Наименьшее значение имеют щелочные элементы, находящиеся в начале периода. Наибольшее – благородные газы, находящиеся в конце периода.
Сродство к ℮ - это энергия, которая выделяется при присоединении ℮ к нейтральному атому, т.е. при превращении атома в анион (-): э0+℮→э-+Еср.
Электроотрицательность (ЭО) – это способность атома притягивать к себе ℮.
При движении слева направо по периодам:
1) R атомов ↓;
2) металличность ↓;
3) энергия ионизации ↑;
4) не металличность ↑;
5) ЭО ↑.
При движении сверху вниз по группам:
1) R атомов ↑;
2) металличность ↑;
3) энергия ионизации ↓;
4) не металличность ↓;
5) ЭО ↓.
6) Сродство к ℮ ↑.
Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем
|
|
|


