 |
Метод молекулярных орбиталей
|
|
|
|
Электроны в молекулах распределены по молекулярным орбиталям (МО), к-ые подобно АО характеризуются определённой энергией и формой. В отл. от АО, МО охватывают не один атом, а всю молекулу, т.е. являются двух- и многоцентровыми.
Наиболее широко в ММО используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил:
1) Число МО равно общему числу АО, из которых комбинируются МО.
2) Энергия одних МО оказывается выше, других - ниже энергии исходных АО. Средняя энергия МО, полученных из набора АО, приблизительно совпадает со ср.энергией этих АО.
3) Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Гунда.
4) Наиболее эффективно комбинируются АО с теми АО, которые характеризуются сопоставимыми энергиями и соответствующей симметрией.
5) Прочность связи в методе МО пропорциональна степени перекрывания атомных орбиталей.
Если обозначить АО атомов А и В через  и
и 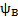 , а МО через
, а МО через  , то согласно ЛКАО
, то согласно ЛКАО
 = a
= a  ± b
± b 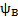
где  - волновая ф-ция электрона в молекуле (МО), a и b - коэф-ты, учитывающие долю каждой АО в образовании МО,
- волновая ф-ция электрона в молекуле (МО), a и b - коэф-ты, учитывающие долю каждой АО в образовании МО,  и
и 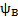 - волновые ф-ции электронов (АО) соответственно в атомах A и В.
- волновые ф-ции электронов (АО) соответственно в атомах A и В.
При знаке плюс получаем связывающие МО, при знаке минус - разрыхляющие МО*.
В связывающих МО эл.плотность сосредоточена между ядрами -> снижение энергии молекулы и её упрочнение.
В разрыхляющих МО* эл.плотность между ядрами понижена -> атомы не связаны в молекулу.
Энергия связывающих МО ниже энергии разрыхляющих МО*.


1) Диаграмма энергетических уровней АО атомов и МО двухатомных молекул.
2) Контурные формы связывающих (слева) и разрыхляющих (справа) МО.
Порядок и энергия связи.
|
|
|
Порядок связи n=(Nсв-Nр)/2.
Nсв – число e на связывающих МО, Nр – число e на разрыхляющих МО*.
Если Nсв = Nр, то n=0 и молекула не образуется. С увеличением n в однотипных молекулах растёт энергия связи. В отличие от метода АО, в методе МО допускается, что связь может быть образована не только парой, но и одним электроном -> порядок связи может быть не только целым, но и дробным (1/2, 1, 3/2, 2, 5/2, 3…)
C равнение методов ВС и МО.
ММО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях - молекулярных орбиталях.
МВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами.
Общее:
1) Они дают одинаковое распределение эл. плотности в соединениях.
2) Условием образования хим.связи явл. перекрывание АО, причём плотность связи растёт с увеличением эл.плотности между ядрами.
3) в зависимости от типа АО образуются σ-, π- и δ- связи.
Достоинством МВС является наглядность: насыщаемость связи объясняется как максимальная ковалентность, направленность вытекает из направленности атомных и гибридных орбиталей; дипольный момент молекулы складывается из дипольных моментов связей, разности ОЭО атомов, образующих молекулу, и наличия неподелённых электронных пар.
ММО более универсален, он легко предсказывает устойчивость молекулярных ионов и атомов в сравнении с молекулами и объясняет магнетизм и окраску вещества. Но ММО более сложен, менее нагляден и не даёт характеристику отдельных атомов в молекулах. Поэтому методы ВС и МО взаимно дополняют друг друга.
Ионная связь и ее свойства.
Ионная связь - электростатическое взаимодействие положительно и отрицательно заряженных ионов, возникает между атомами с большой разницей ЭО.
Ионная связь необладает насыщаемостью
|
|
|
|
|
|


