 |
Каркасно-двигательная система и ее биологическое значение
|
|
|
|
Каркасно-двигательная система (цитоскелет ) клетки, подобно скелету и мышечной системе организма, осуществляет фиксацию составных частей клетки в определенном положении и обеспечивает клеточные формы движения. Большую роль эта система играет также в процессах, связанных с делением клетки. Опорно-двигательная система клетки образована тремя основными элементами: микротрубочками, микрофиламентами и промежуточными филаментами.



Указанные элементы входят также в состав ряда других более сложно организованных органелл (ресничек, жгутиков, микроворсинок, клеточного центра) и клеточных соединений (десмосом и др.).
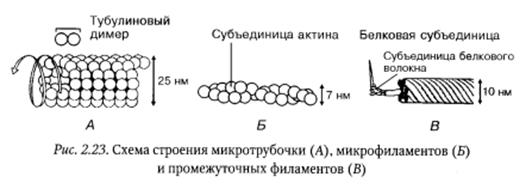
Микротрубочки — полые цилиндры: диаметром 22—28 нм, длина которых: широко варьирует. Их стенка состоит из спиралевидно уложенных нитей — протофиламентов толщиной 5 нм, образованных глобулярными белками — тубулинами. Молекула тубулина представляет собой гетеродимер, состоящий из двух разных субъедниц: α-тубулина и β-тубулина, которые при ассоциации образуют собственно белок тубулин. Такая конструкция обеспечивает необходимую прочность микротрубочек при минимальной их массе. Микротрубочки очень лабильные структуры постоянно находящиеся в состоянии полимеризации и деполимеризации их концевых участков.
У большинства микротрубочек один конец, обозначаемый как минус («-») закреплен, а другой конец — плюс («+») — свободен и участвует в их удлинении в результате реакций полимеризации и деполимеризации тубулинов.
Большую роль в образовании микротрубочек играют особые мелкие сферические тельца — сателлиты (oт англ. satellite — спутник), которые называют также центрами организации микротрубочек. Сателлиты содержатся в клеточном центре и базальных тельцах ресничек.
|
|
|
Микротрубочки обеспечивают внутриклеточный транспорт и направленное перемещение секреторных, транспортных пузырьков, органелл и других структур клетки. Движение указанных частиц вдоль микротрубочек осуществляется «боковыми ручками», специальными молекулярными структурами, образованными разнообразными крупными «моторными» белками кинезинами и динеинами, ассоциированными с микротрубочками. Кинезины переносят транспортные, секреторные пузырьки и органеллы клетки от центра ее к периферии, динеины — от периферии к центру. Боковая ручка избирательно связывается с определенной частицей и, изгибаясь, передает ее на следующую ручку и т. д. Благодаря сопряженным волнообразным движениям таких ручек частица передвигается вдоль микротрубочки.

Микротрубочки структурно более сложны чем актиновые филаменты, но они также и высоко динамичны и грают разные и важные роли в клетке. Микротрубочки – это полимеры белка тубулина. Сам тубулин – это гетеродимер, образованный из двух близкородственных глобулярных белков – α- и β-тубулина, в каждой из которых насчитывается 445-450 аминокислотных остатков, субъединицы связаны прочно друг с другом ковалентной связью. (Figure 16–42A).
Эти два тубулиновых белка находятся только в гетеродимерной форме, и каждый мономер – α и β – имеет сайт связывания с одной молекулой ГТФ. Молекула ГТФ, связанная с α-тубулином, заперта в ловушке, поскольку находится внутри димера – в месте взаимодействия мономеров, и она никогда не гидролизуется и не обменивается, поэтому её можно рассматривать как составную (интегральную) часть димерной структуры. А вот нуклеотид в β-тубулине может быть либо в форме ГТФ, либо в ГДФ и также может обмениваться в растворимой форме (неполимеризованной) тубулинового димера. Тубулин присутствует во всех эукариотических клетках, и он существует во множестве изоформ. Тубулины дрожжей и человека идентичны на 75% по аминокислотной последовательности. У млекопитающих существует как минимум 6 форм α-тубулина и такое же число β-тубулинов, каждый их которых кодируется своим геном. Различные формы тубулина очень похожи, и в общем случае они могут сополимеризоваться в пробирке в смешанные микротрубочки. Тем не менее, эти разные тубулины могут находиться в клетке в разных местах и тканях, а также выполнять слегка отличные функции. В качестве наглядного примера можно привести паралич глазного яблока (оно не может двигаться) из-за паралича окулярного нерва, причиной которого служат мутации в определенном гене β-тубулина. Многие неврологические болезни человека связаны со специфическими мутациями в разных тубулиновых генах.
|
|
|
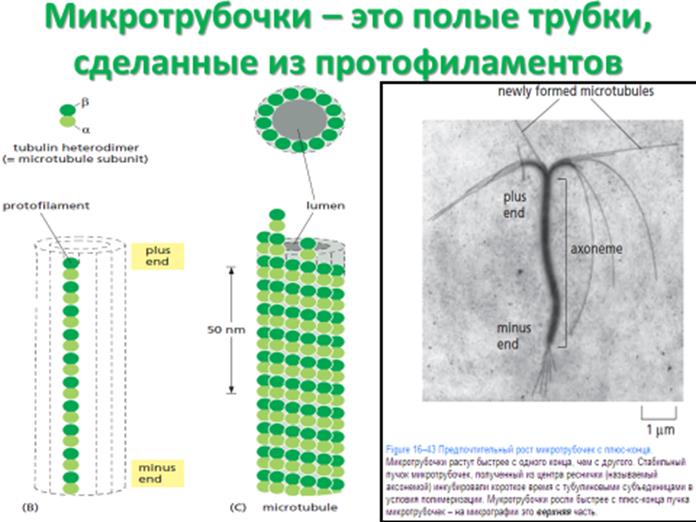
Микротрубочка – это полая цилиндрическая структура, построенная из 13 параллельных протофиламентов, каждый из которых состоит из αβ-тубулиновых гетеродимеров, уложенных стопкой способом «голова к хвосту», а затем свернутых в трубку. (Figure 16–42B–D). При сборке микротрубочек формируются два новых белок-белковых контакта. Вдоль продольной оси микротрубочки верхушка β-тубулиновой молекулы образует место взаимодействия с низом α-тубулиновой молекулы соседнего гетеродимера. Такое взаимодействие очень схоже с тем, что удерживает α и β-мономеры вместе в димерной субъединице, при этом энергия связи высока. Перпендикулярно этому взаимодействию соседние протофиламенты формируют латеральные контакты. В этом направлении основные латеральные контакты образуются между мономерами того же типа (то есть α – α и β – β). Поскольку продольные и латеральные контакты повторяются во время сборки, небольшой сдвиг в латеральных контактах приводит к спиралевидной форме укладки (в решётке) в микротрубочке. Поскольку множественные контакты внутри решетки микротрубочки удерживают большинство субъединиц в микротрубочке, добавление и удаление субъединиц происходит практически исключительно на концах. Эти множественные контакты придают микротрубочке упругость, и её трудно изогнуть. Постоянная длина микротрубочки – это несколько миллиметров, и микротрубочки – это самые упругие и прочные структурные элементы, из всех в большинстве клеток животных. Субъединицы каждого протофиламента в микротрубочке ориентированы в одном и том же направлении, а сами протофиламенты параллельны друг другу.
|
|
|
Таким образом, решетка микротрубочки сама по себе имеет структурную полярность: α-субъединицы находятся со стороны минус-конца, а β-субъединицы – со стороны плюс-конца.
Как и для актиновых филаментов, регулярная параллельная ориентация субъединиц придает микротрубочкам структурную полярность: плюс-концы растут или укорачиваются быстрее. (Figure 16–43)




В клетках животных микротрубочки участвуют в образовании центриолей, базальных телец, аксонем, ресничек и жгутиков. В делящихся клетках они образуют веретено деления. Колхицин, винбластин и другие препараты, способные нарушать процесс полимеризации тубулинов и рост микротрубочек, препятствуют расхождению хромосом к полюсам клетки при митозе и мейозе и вызывают избирательную гибель быстроделящихся клеток. Поэтому некоторые из таких веществ используются для химиотерапии опухолей.
Микрофиламенты представляют собой тонкие белковые нити диаметром 5-7 нм, состоящие из двух спирально закрученных нитей, образованных глобулярным белком — актином. На долю этого белка приходится более 10 %всех белков клетки. При образовании микрофиламентов мономерная форма актина первоначально полимеризуется с образованием актиновых димеров и затем тримеров. Дальнейший рост микрофиламентов осуществляется путем присоединения актиновых мономеров к обоим концам актинового фи- ламента. В клетке микрофиламенты организованы в высокоупорядоченные структуры двух типов: актиновые пучки, состоящие из параллельно расположенных нитей, и актиновые сети. В образовании актиновых пучков и актиновых сетей и связи их с другими структурами клетки, например плазматической мембраной, значительную роль играют различные актин-связывающие белки. В животных клетках микрофиламенты образуют хорошо развитую кортикальную сеть, расположенную под плазмалеммой и составляющую основу субмебранного комплекса поверхностного аппарата клетки.
|
|
|
Микрофиламенты обеспечивают сократительные функции. Участвуют в образовании псевдоподий, сократительного кольца при делении клетки. Принимают участие в формировании микроворсинок и структур, обеспечивающих межклеточные контакты.
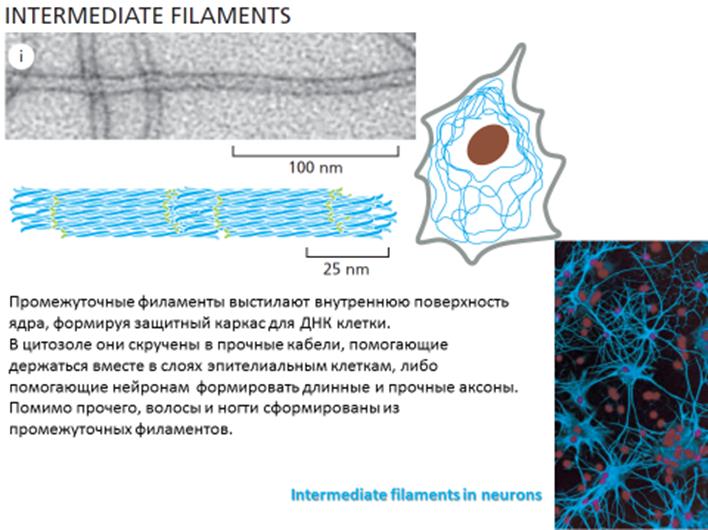
Промежуточные филаменты образованы жесткими и прочными белковыми волокнами, перевитыми попарно или по трое между собой, которые соединяются боковыми сшивками в длинный тяж, похожий на канат. По своему диаметру (8—10 нм) занимают промежуточное положение между микрофиламентами и микротрубочками. В отличие от микротрубочек и микрофиламентов, полимерные молекулы которых построены из одного типа мономеров, промежуточные филаменты состоят из различных белков, специфичных для разных типов клеток. Мономером промежуточных филаментов служит полипептид, в котором выделяют центральный домен, состоящий примерно из 350 аминокислот, а также «голову» и «хвост», расположенные соответственно на N—С-концах белковой молекулы и имеющие вариабельные размеры. Последовательность этапов сборки промежуточных филаментов представлена на рисунке:

Промежуточные филаменты, по сравнению с микротрубочками и микрофиламентами, отличаются большой стабильностью и устойчивостью. Располагаются промежуточные филаменты в цитоплазме клеток обычно параллельно поверхности клеточного ядра. Хотя строение промежуточных филаментов в клетках различных типов сходно, они существенно различаются по своей молекулярной массе и химической природе. В клетках человека различают 6 основных классов промежуточных филаментов. Идентификация их имеет большое значение в диагностике опухолей для выявления тканевой принадлежности опухолевых клеток.
Промежуточные филаменты поддерживают форму клетки и противостоят растягивающим механическим воздействиям. Кроме того, они удерживают, «заякоривают» ядро и некоторые органеллы в клетке. Особый класс промежуточных филаментов образует ядерную пластинку — ламину.

|
|
|


