 |
и реализации генетической информации
|
|
|
|
Система сохранения, воспроизведения и реализации генетической информации представлена ядром. Ядро — наиболее крупная структура эукариотической клетки — имеет, как правило, округлую или овальную форму. В клетках с высокой физиологической активностью (железистые клетки, некоторые лейкоциты) ядра принимают лопастную или еще более сложную сегментированную форму, что увеличивает отношение площади поверхности этой структуры к ее объему. Размеры ядра колеблются от 1 мкм (у некоторых простейших) до 1 мм (в яйцах некоторых рыб и земноводных). В клетках большинства эукариот содержится одно ядро. Однако встречаются и многоядерные клетки, которые образуются вследствие деления клеток, не сопровождающегося цитотомией, или слияния нескольких одноядерных клеток. Такие структуры называют симпластами. Некоторые клетки, как, например, эритроциты, вовсе не имеют ядер.
В состав ядра входят поверхностный аппарат, кариоплазма, ядерный матрикс и генетический материал, представленный в неделящихся клетках эухроматином и гетерохроматином. В свою очередь, поверхностный аппарат ядра включает ядерную оболочку, ядерный поровый комплекс и периферическую плотную пластинку, или ламину (рис. 2.29).

Ядерная оболочка, или кариолемма, состоит из двух мембран, разделенных перинуклеарным пространством размером 20-40 нм. Внешняя (наружная) ядерная мембрана связана с мембранами шероховатого эндоплазматического ретикулума и усеяна рибосомами, участвующими в синтезе белков. Перинуклеарное пространство сообщается с полостью шероховатой эндоплазматической сети. В мембранах ядерной оболочки имеется большое количество различных ферментов, что свидетельствует о ее активной метаболической функции. По всей поверхности ядерной мембраны расположены ядерные поры, число которых может достигать 2000-4000 (рис. 2.30).
|
|
|

В области краев поры наружная и внутренняя мембраны сливаются с образованием округлого отверстия диаметром 120 нм. В порах располагаются сложные белковые структуры, называемые ядерными поровыми комплексами.
Ядерный поровый комплекс представляет собой супрамолекулярную структуру, включающую около 1000 белков-нуклеопоринов, масса которой в 30 раз больше массы рибосомы.
Согласно одной из моделей, комплекс состоит из цитоплазматического и нуклеоплазматического колец диаметром около 120 цитоплазматических фибрилл, центральной части и ядерной «корзины» (рис.2.31).

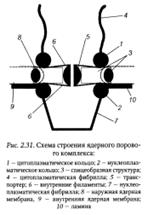
Центральная часть содержит 8 спиц, расположенных между нуклеоплазматическим и ядерными цитоплазматическими кольцами. Эта спицевая структура окружает белковый транспортер, имеющий центральный канал, внутренний диаметр которого может изменяться от 9 до 26 нм. Через этот канал осуществляется транспорт веществ из цитоплазмы в ядро и обратно. На цитоплазматическом кольце расположены, как бусы на нитке, 8 гранул, содержащих короткие фибриллы длиной примерно 50 нм, направленные в сторону гиалоплазмы. От нуклеоплазматического кольца также отходят в сторону нуклеоплазмы 8 фибрилл длиной около 100 нм, образуя структуру, похожую на баскетбольную корзину.
Через ядерные поры из цитоплазмы в ядро транспортируются молекулы гистонов, белковые факторы транскрипции, ДНК-, РНК-полимеразы и другие ферменты, участвующие в синтезе ДНК и РНК. Из ядра в цитоплазму экспортируются различные виды РНК, а также малые и большие субъединицы рибосом.
Ионы и малые нейтральные белки проникают через ядерный поровый комплекс экспортируют комплекс посредством диффузии. Большие молекулы белков (ДНК и РНК-полимеразы и др.) переносятся через центральный канал ядерной поры только в составе транспортных комплексов и с затратой энергии (рис. 2.32).
|
|
|
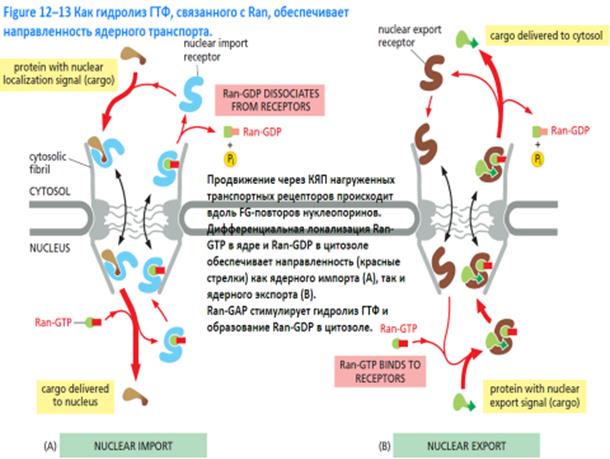
Как правило, белки, транспортируемые из гиалоплазмы в ядро, имеют сигнальные участки с определенной аминокислотной последовательностью, называемые сигналами ядерной локализации (NLS).
Наиболее хорошо изучен транспорт из цитоплазмы в ядро белковых молекул, осуществляемый с участием белков-импортинов, распознающих переносимые молекулы белков по характерным для них сигнальным последовательностям, и белка Ran, связывающего гуанозинтрифосфат (ГТФ) и гуанозин-дифосфат (ГДФ).
Механизм транспорта связан с градиентом концентраций комплексов RanГДФ и RanГТФ, возникающим по обе стороны ядерной мембраны: комплекс RanГТФ находится преимущественно в ядре, а комплекс RanГДФ — в цитоплазме. Это обусловлено тем, что ферменты, вызывающие замещение связанного с белком RanГДФ на ГТФ, локализуются на внутренней стороне ядерной мембраны, тогда как ферменты, гидролизующие RanГТФ до RanГДФ, располагаются на цитоплазматической стороне мембраны.
Импорт белков через ядерную пору включает пять последовательных этапов (рис. 2.33):
4. Распознавание транспортируемого белка, имеющего сигнал ядерной локализации, комплексом белок-импортин — RanГДФ.
5. Связывание образующегося комплекса с белками цитоплазматических филаментов порового комплекса.
6. Перенос белкового комплекса, включающего транспортируемый белок-импортин — RanГДФ, через центральный канал порового комплекса.
7. Ферментативное замещение связанного с белком RanГДФ на ГТФ и освобождение транспортируемого белкa из комплекса.
8. Перенос комплекса импортин — RanГТФ через ядерный поровый комплекс с последующим ферментативным гидролизом ГТФ до ГДФ.
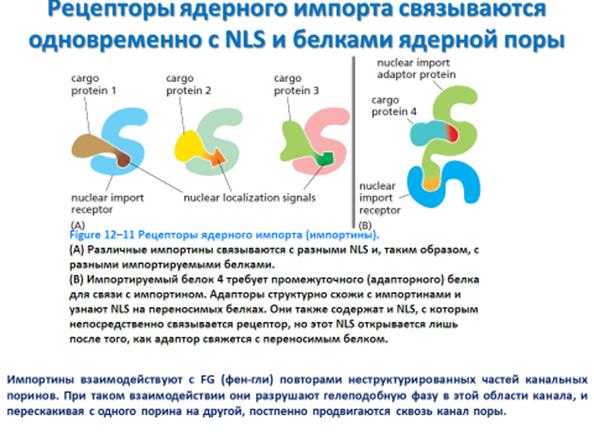
Такой градиент двух конформационных форм Ran поддерживает ядерный транспорт в нужном направлении. Докинг рецепторов импорта на FG-повторы с цитозольной стороны поры осуществляется вне зависимости от того, нагружен рецептор своим карго или нет. Затем рецепторы импорта, при помощи связывания с FG-повторами, входят в канал. Если они достигают ядерной стороны порового комплекса, то с ними связывается Ran-GTP и, если рецепторы прибыли с грузом, связывание с Ran-GTP вызывает высвобождение груза (Figure 12–13A).
|
|
|
Поскольку Ran-GDP в цитозоле не связывается с рецепторами импорта (или экспорта), разгрузка происходит лишь на ядерной стороне поры. Таким образом, нахождение Ran-GTP преимущественно в ядре создает направленность процесса импорта.
Отгрузив свой груз в ядро, пустой рецептор импорта в связанной с Ran-GTP форме транспортируется назад через пору в цитозоль. Там Ran-GAP вызовет гидролиз ГТФ, связанного с Ran, то есть произойдет конверсия Ran-GTP в Ran-GDP, а он отсоединится от рецептора. Теперь рецептор готов к новому циклу ядерного импорта.
Экспорт из ядра происходит по похожему механизму, с той разницей, что Ran-GTP в ядре способствует связыванию груза с рецептором, а не его диссоциацию. При достижении цитозоля рецептор встречается с Ran-GAP, тот конвертирует Ran-GTP в Ran-GDP, и в результате рецептор отсоединяется как от своего груза, так и от Ran-GDP в цитозоле. Свободный рецептор экспорта возвращается в ядро для завершения этого цикла и начала нового.

Периферическая плотная пластинка, или ядерная ламина, связана с внутренней поверхностью внутренней ядерной мембраны с помощью специальных белков на всем ее протяжении, исключая области пор (рис. 2.34).


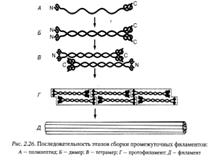
Ламина состоит из белков ламинов и служит основным элементом кариоскелета. Белки ламины имеют молекулярную массу 60—90 кДа и относятся к промежуточным филаментам цитоскелета. Первым шагом на пути образования ламины служит взаимодействие ламиновых полипептидных мономеров с формированием ламиновых димеров. Центральный участок таких димеров состоит из двух полипептидных цепей, закрученных одна вокруг другой, а концевые участки их образованы глобулярными структурами. Димеры, соединяясь друг с другом по принципу «хвост-голова», образуют длинные полимерные нити, которые в результате боковых взаимодействий формируют фибриллы ламины (см. рис. 2.26).
К ламине присоединяются своими центромерными и теломерными участками нити хроматина (хромосом), что обеспечивает упорядоченное расположение их в ядре. С ламиной соединяются также тонкие ламиновые фибриллы, толщиной 2—3 нм, которые пронизывают кариоплазму ядра и образуют ядерный матрикс. Ламина — лабильная структура. В профазе митоза под действием ферментов белки ламины фосфорилируются, и ламина разрушается. На завершающем этапе митоза дефосфорилирование ламинов протеинфосфатазами способствует восстановлению исходной структуры ламины.
|
|
|
Ламина вместе с ядерным матриксом формируют единую систему ка- риоскелета. Кариоскелет поддерживает форму ядра и обеспечивает определенное расположение хромосом в пространстве.
Таким образом, поверхностный аппарат ядра, или кариотека, обеспечивает изоляцию содержимого ядра от гиалоплазмы, благодаря чему достигается разделение в пространстве и времени процессов транскрипции и трансляции, а также осуществляет регулируемый обмен веществами между ядром и цитоплазмой. Разделение во времени и пространстве транскрипции и трансляции служит основой для протекания сложных процессов созревания РНК и играет большую роль в регуляции экспрессии эукариотических генов (см. гл. 4). Кроме того, поверхностный аппарат предохраняет ядерную ДНК от воздействия на нее жестких структур цитоскелета и разрушительных ферментных систем цитоплазмы.
Кариоплазма (нуклеоплазма или ядерный сок), представляет собой желеобразный раствор, в котором находятся разнообразные белки, нуклеотиды и ионы. Химический состав ее в основном сходен с составом гиалоплазмы, хотя имеются и некоторые отличия. В кариоплазму погружены хроматин и ядрышко, в ней располагается также ядерный матрикс.
Ядрышко - структурный элемент неделящегося ядра, состоящий из созревающих субъединиц рибосом и фибрилл ядерного матрикса, соединенных с центромерными участками хромосом, несущих множество копий генов рРНК. Такие участки хромосом называются ядрышковыми организаторами. Например, у человека они содержатся в 13 — 15-й и 21—22-й парах хромосом.
Ядрышковый организатор содержит многократно повторенные рядом расположенные гены, кодирующие 5,8S, 18S и 28S РНК, которые транксрибируются как единое целое в виде молекулы пре-рРНК, а также расположенный отдельно ген короткой 5S РНК.
По разным оценкам, у человека насчитывается от 200 до 2000 копий каждого гена рРНК. Ядрышко обнаруживается только в период интерфазы и исчезает в профазе митоза, когда ядрышковые организаторы «растаскиваются» в ходе конденсации соответствующих хромосом; вновь формирование ядрышек происходит в телофазе митоза. Основная функция ядрышек — синтез и процессинг рРНК и сборка субъединиц рибосом.
|
|
|
При транскрипции генов ядрышковых организаторов первоначально синтезируется крупная молекула пре-рРНК, которая в ядрышке подвергается химической модификации процессингу. В ходе процессинга нре-рРНК разрезается с образованием трех отдельных молекул рРНК (5,8S,18S и 28S), которые вместе с 5S РНК связываются с белками и образуют предшественников большой и малой субъединиц рибосом. Предшественники рибосомальных субъединиц далее но отдельности транспортируются через ядерные поры в цитоплазму, где завершается формирование малой и больший субъединиц рибосом.
Размеры и число ядрышек увеличиваются при повышении функциональной активности клетки. Особенно крупные ядрышки характерны для клеток, активно синтезирующих белки.
Генетический материал ядра представляет собой хроматин.
Хроматин состоит из дезоксирибонуклеопротеинов (комплекса ДНК с белками) и представляет собой совокупность всех хромосом интерфазного ядра клетки. Белки хроматина по физико-химическим свойствам и биологической активности разделяют на две группы: основные (гистоновые) белки, на их долю приходится 60—80 % массы всех хромосомных белков, и кислые (негистоновые) белки.
Гистоновые белки включают 5 главных видов белков (HI, Н2А, Н2В, НЗ и Н4), содержащих большое количество положительно заряженных аминокислотных остатков, и характеризуются основными (щелочными) свойствами, благодаря этому они образуют устойчивые комплексы с молекулами ДНК, фосфатные группы которых несут отрицательный заряд. Гистоновые белки обеспечивают пространственную организацию (компактизацию) хроматина. Они участвуют также в регуляции активности генов. Негистоновые белки весьма разнообразны. Их качественный и количественный состав зависят от типа и функционального состояния клетки. Негистоновые белки участвуют в репликации и репарации ДНК, синтезе РНК, регуляции активности генов и др.
Хроматин ядра имеет определенную пространственную организацию, характеризующуюся его компактизацией, или спирализацией. Необходимость компактизации хроматина определяется большой длиной молекул ДНК, которая в клетках человека составляет более 2 м. Например, в вытянутом, то есть деконденсированном, или деспирализованном, состоянии длина молекулы ДНК хромосомы человека может достигать более 6 см, что примерно в тысячу раз превышает диаметр ядра клетки. Тем не менее, все хромосомы человека легко помещаются в ядре благодаря совершенной многоуровневой упаковке молекул ДНК с помощью белков.
Выделяют несколько уровней спирализации (компактизации) хроматина: нуклеосомный, нуклеомерный, хромомерный и хромонемный (рис. 2.35).

Нуклеосомный уровень организации хроматина характеризуется образованием нуклеосом. Указанный уровень организации хроматина обеспечивается четырьмя видами белков гистонов (Н2А, Н2В, Н3, Н4), образующими дисковидные белковые частицы — коры, состоящие из 8 молекул гистонов (по две молекулы каждого вида гистонов).
Молекула ДНК, спирально накручиваясь на коры, комплексируется с ними и образует структуру, напоминающую нить бус. При этом тесно контактирует с каждым кором отрезок ДНК длиной 146 пар нуклеотидов (коровая ДНК). Участки ДНК, расположенные между соседними коровыми частицами, называют связующими или линкерными. С каждым линкерным участком, насчитывающем в среднем 60 пар нуклеотидов, связана одна молекула белка гистона Н1. Отрезок молекулы ДНК длиной примерно 200 пар нуклеотидов, состоящий из коровой и линкерной ДНК, вместе с белковым кором составляет нуклеосому (рис. 2.36).

Диаметр нуклеосомы равен 11 нм. Таким образом, в основе нуклеосомного уровня организации хроматина лежит нить — нуклеосомная фибрилла, состоящая из цепочки повторяющихся единиц — нуклеосом. Молекула ДНК в составе нуклеосомной нити участвует в процессах транскрипции.
Нуклеомерный уровень организации хроматина достигается благодаря взаимодействию гистона Н1 одной нуклеосомы с гистонами Н1 других нуклеосом, что приводит к образованию комплекса, состоящего из трех нуклеосом. Такой комплекс называется нуклеомерой или сверхбусиной. В результате образуется нуклеомерная нить хроматина, или элементарная хроматиновая фибрилла, толщиной примерно 30 нм. Образование нуклеомерной нити приводит к тому, что участок ДНК, входящий в ее состав, теряет способность к репликации и транскрипции.
В формировании нуклеосомной фибриллы и элементарной хроматиновой фибриллы, когда укладка ДНК происходит по спиральному или соленоидному типу, основную роль играют гистоновые белки. Другие уровни компактизации хроматина обусловлены иным типом укладки молекул ДНК (в виде петель) и связаны с негистоноными белками.
Хромомерный, или доменно-петлевой, уровень организации хроматина достигается укладкой хроматиновой фибриллы в петли, так называемые петлевые домены, которые прикрепляются к негистоновым белкам ядерного матрикса, выполняющим роль «скелета». Несколько соседних петель, прикрепляясь своими основаниями к общему белковому центру, образуют «розетку», называемую хромомерой, толщиной 120 нм.
Дальнейшая компактизация ДНК происходит только при вступлении клетки в митоз. В результате более тесного прилегания петель в хромомерах и самих хромомер друг к другу образуются хроматиновые фибриллы хромонемы толщиной 300 нм. Хромонемы, в свою очередь, благодаря еще более компактной укладке, формируют хорошо различимые в световой микроскоп хроматиновые фибриллы — хроматиды толщиной 700 нм. Сестринские хроматиды, соединяясь друг с другом в области центромеры, образуют хромосомы. В итоге длина молекулы ДНК в результате всех уровней ее укладки сокращается примерно в 10 000 раз.
В неделящихся клетках степень спирализации хроматиновых нитей на всем протяжении их не одинакова. Выделяют две разновидности хроматина — деконденсированный (деспирализованный) эухроматин, различимый лишь под электронным микроскопом, и конденсированный — гетерохроматин, выявляемый в виде глыбок под световым микроскопом.
Эухроматин содержит транскрибируемые участки ДНК, тогда как ге- терохроматин не транскрибируется. В зависимости от функционального состояния клетки возможен переход гетерохроматина в эухроматин и обратно. В связи с этим гетерохроматин подразделяют на два вида: факультативный и конститутивный гетерохроматин.
Факультативный гетерохроматин при определенных условиях может превращаться в эухроматин, конститутивный гетерохроматин никогда не превращается в эухроматин.
Таким образом, по морфологическим признакам ядра (соотношению содержания эу- и гетерохроматина) можно оценить активность процессов транскрипции, а следовательно, синтетической функции клетки. При усилении синтеза белка содержание эухроматина по отношению к гетерохроматину возрастает, при снижении, наоборот, возрастает содержание гетерохроматина.
Вступление клетки в митоз или мейоз, как отмечалось выше, сопровождается суперспирализацией хроматина и образованием хромосом, которые становятся хорошо различимыми в световой микроскоп. Этот процесс начинается в профазе и достигает своей максимальной выраженности в метафазе митоза.
Каждая метафазная хромосома состоит из двух сестринских хроматид (см. рис. 2.37).

Хроматиды представляют собой структурные элементы хромосомы, содержащие идентичные молекулы ДНК, образующиеся при репликации ДНК в синтетический период жизненного цикла клетки. Хроматиды соединены друг с другом в области первичной перетяжки — центромеры. Участки от центромеры до концов хромосомы называются плечами. В зависимости от места расположения центромеры различают три типа хромосом: метацентрические (равноплечие), субметацентрические (неравноплечие) и акроцентрические, имеющие палочковидную форму с очень коротким, почти незаметным придатком (вторым плечом).
Некоторые хромосомы имеют глубокие вторичные перетяжки, отделяющие небольшие участки хромосом, называемые спутниками (рис. 2.37). В телофазе митоза происходит декомпактизация вещества хромосом, которое приобретает структуру интерфазного хроматина.

|
|
|


