 |
Химические свойства карбонильных соединений
|
|
|
|
Карбонильная группа содержит полярную углерод-кислородную двойную связь, p-электроны которой смещены от атома углерода к более электроотрицательному атому кислорода:
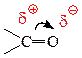
Следовательно, атом кислорода является электроноизбыточным центром, а атом углерода – электронодефицитным. Поэтому, для карбонильных соединений характерны реакции присоединения различных группировок по месту разрыва двойной связи.
1) Реакции нуклеофильного присоединения A N. В качестве нуклеофилов могут выступать: H2O, ROH, HCN, NaHSO3, RMgI. Реакция с натрий-гидросульфитом является качественной на альдегиды и метилкетоны – выпадает прозрачный кристаллический осадок.
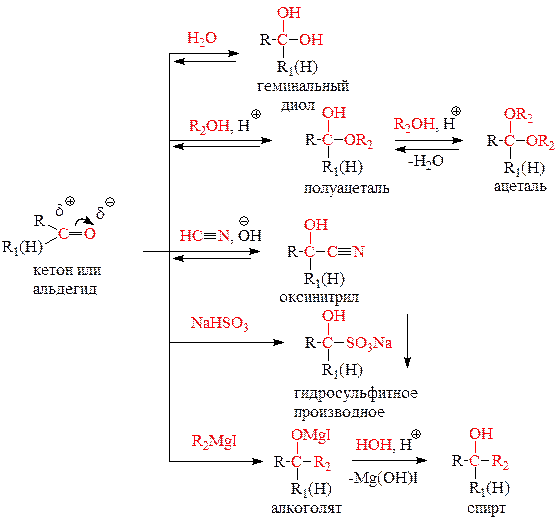
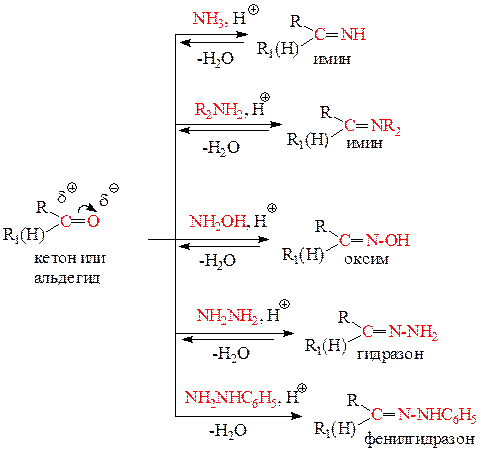
2) Реакции нуклеофильного замещения кислорода карбонильной группы на азот N -нуклеофилами S N. В качестве N -нуклеофилов могут выступать: NH3 (аммиак), RNH2 (амины), NH2OH (гидроксиламин), NH2NH2 (гидразин), NH2-NH-C6H5 (фенилгидразин).
3) Реакции конденсации – реакции присоединения или замещения атома кислорода карбонильной группы, приводящие к образованию новой углерод-углеродной связи. В реакции участвуют карбонильная компонента – субстрат, в роли которой может быть альдегид или кетон и метиленовая компонента – реагент, в роли которой может быть С-Н кислота: альдегиды, кетоны, сложные эфиры, ангидриды кислот и нитросоединения. Если в реакции конденсации участвуют альдегиды или кетоны, то называют такую реакцию альдольно-кротоновой конденсацией.
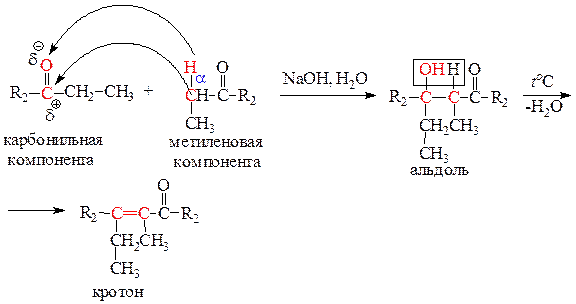
4) Реакции окисления альдегидов протекают в мягких условиях с образованием карбоновых кислот. Реакции «серебряного зеркала» и окисление медь-гидроксидом являются качественными на альдегидную группу. Исключение составляют ароматические альдегиды, которые не окисляются Cu(OH)2. Кетоны окисляются в более жестких условиях, реакции идут с разрывом углерод-углеродной связи.
|
|
|

5) Реакции восстановления альдегидов приводят к образованию первичных спиртов, кетонов – вторичных спиртов. В качестве восстановителей могут использоваться: Н2 / Ni; NaBH4, LiAlH4.
6) Реакции окисления-восстановления (диспропорционирования) - реакция Канниццаро, характерна для альдегидов не содержащих при α-атоме углерода водородных атомов. Одна молекула альдегида восстанавливается в спирт за счет окисления второй молекулы в кислоту.

7) Реакции по углеводородному заместителю
а) Галоформная реакция – качественная реакция для метилкетонов и уксусного альдегида – выпадает желтый осадок иодоформа.
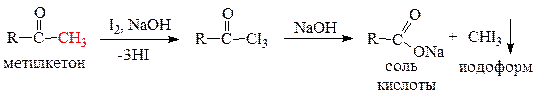
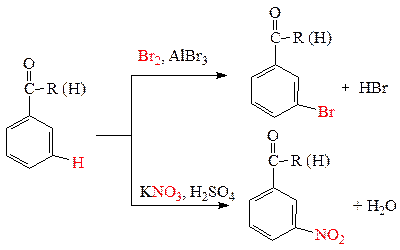
б) Реакции по ароматическому циклу. Карбонильная группа относится к заместителям II рода (мета -ориентантам), т.е. замещение водорода на электрофил происходит в мета- положении.
Решение
Путем последовательных превращений синтезируем из
метилацетилена пентан-2-он.
Проанализируем конечный продукт. В данном соединении углеродный скелет содержит пять атомов углерода, в исходном - три. Следовательно, необходимо удлинить углеродный скелет исходной молекулы на два атома углерода. Для этого проведем замещение атома водорода при углероде концевой тройной связи на металл, получим соль ацетиленида. Далее увеличим количество углеродов путем взаимодействия ацетиленида натрия с галогенопроизводным углеводородом, содержащим два атома углерода, например, этилхлоридом.
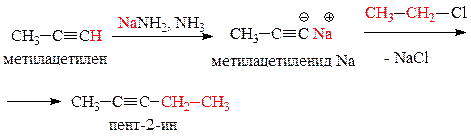
Для получения из пент-1-ина пентан-2-она, выполним реакцию присоединения воды к алкинам по Кучерову:
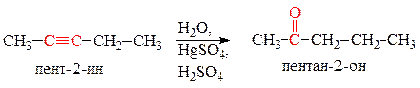
Приведем уравнения реакций пентан-2-она с соответствующими реагентами: CH3MgI, затем H2O; I2, NaOH; NaOH, H2O. Назовем конечные продукты реакций.
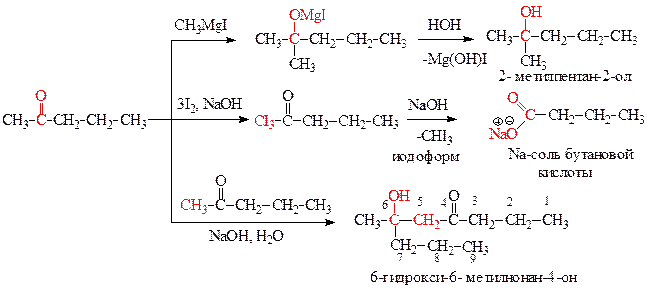
Пример решения задачи 26
Заполните схему превращений, назовите промежуточные и конечные продукты.
|
|
|
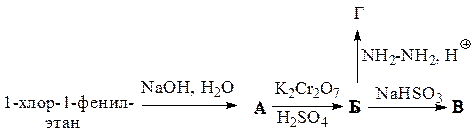
|
Выполнение данной схемы превращений требует знаний способов получения и химические свойства карбонильных соединений.
Приведем решение данной схемы и назовем образующиеся на каждой стадии продукты:
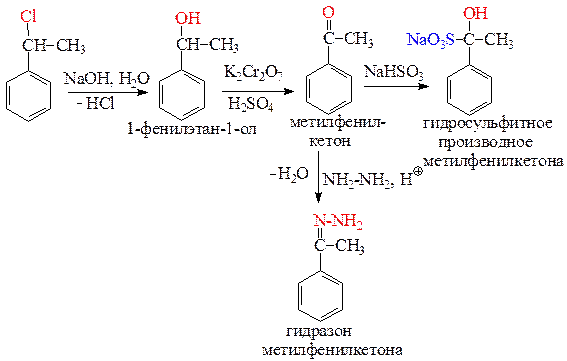
Пример решения задачи 27
Функциональные производные карбоновых кислот - это все соединения, которые образуются в результате химических превращений в карбоксильной группе.
Если химическая реакция протекает по углеводородному радикалу карбоновой кислоты и не затрагивает карбоксильную группу, то в результате получаются замещенные карбоновые кислоты.
К основным функциональным производным карбоновых кислот относятся: соли, галогенангидриды, ангидриды, сложные эфиры, амиды и нитрилы. Приведем реакции их получения из соответствующей кислоты.
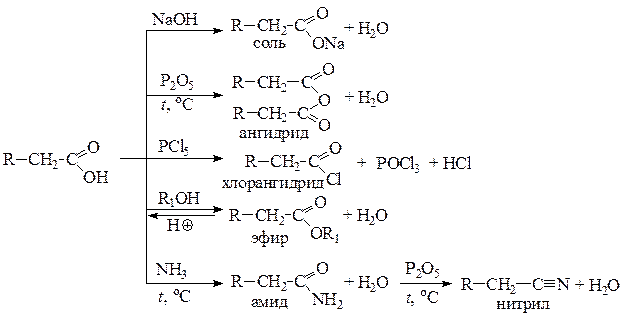
По кислотным свойствам карбоновые кислоты превосходят спирты, фенолы и угольную кислоту. Поэтому в реакциях с карбонатами карбоновые кислоты вытесняют угольную кислоту, которая разлагается с образованием углекислого газа и воды. Реакция с карбонатами является качественной на открытие карбоксильной группы.
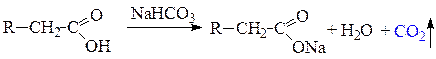
Гидролиз всех функциональных производных в зависимости от рН среды в конечном результате приводит к образованию родоначальной карбоновой кислоты (в кислой среде) или ее соли (в щелочной среде).
Ангидриды:
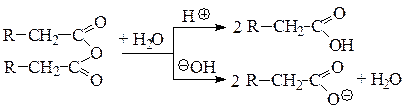
Галогенангидриды:

Сложные эфиры:
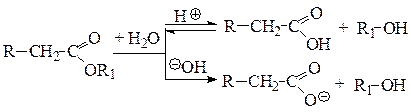
Реакция щелочного гидролиза в присутствии индикатора фенолфталеина используется для обнаружения сложных эфиров и может рассматриваться как качественная. При гидролизе происходит нейтрализация щелочи образующейся кислотой и малиновая окраска фенолфталеина исчезает.
Амиды
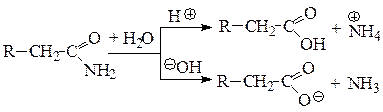
Нитрилы:

Реакция ацилирования - замещение подвижного водорода или металла в реагенте на ацильную группу субстрата.
Ацилирующими средствами (поставщиками ацильной группы) являются галогенангидриды, ангидриды, карбоновые кислоты, сложные эфиры и амиды. Сила ацилирующего средства зависит от величины d+ заряда на атоме углерода карбонильной группы. Чем выше d+ заряд, тем легче идет атака нуклеофилом, тем выше скорость реакции ацилирования. В галогенангидридах благодаря преобладающему отрицательному индуктивному эффекту (-I) d+ заряд на карбонильном углероде повышается. В остальных ацилирующих средствах преобладает положительный мезомерный эффект (+М), который понижает d+ заряд, но в различной степени. В ангидридах +М эффект разделяется на две карбонильные группы и его влияние на величину d+ в два раза меньше, чем в кислотах, эфирах и амидах. Наиболее сильный +М эффект наблюдается в амидах (так как азот слабее удерживает свою неподеленную электронную пару, чем кислород ввиду меньшей электроотрицательности), поэтому d+ заряд на карбонильном углероде будет наименьший в ряду ацилирующих средств. Карбоновые кислоты и сложные эфиры являются практически одинаковыми по силе ацилирующими средствами. Исходя из выше сказанного ряд активности ацилирующих средств выглядит следующим образом:
|
|
|
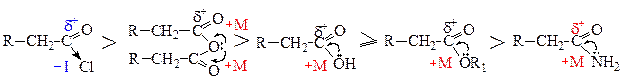
Решение
1. Напишем уравнения реакций получения из диметилуксусной кислоты (А) ее производных: а) бариевой соли; б) хлорангидрида; в) ангидрида; г) сложного эфира (реакцией этерификации с пропан-1-олом); д) амида. Назовем полученные соединения.
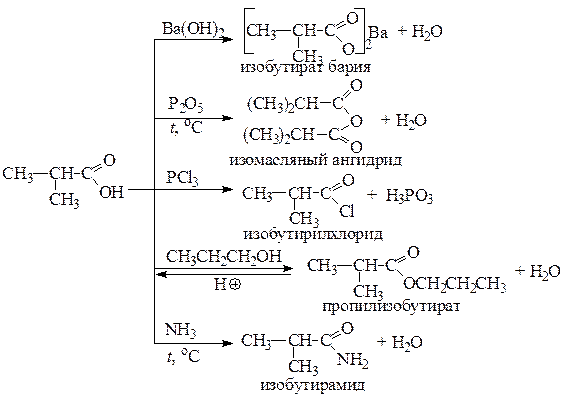
2. Приведем уравнения реакций гидролиза в кислой и щелочной среде N, N -диметилизобутирамида (Б).
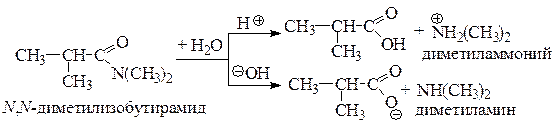
Используя ряд активности ацилирующих средств сравним активность в реакциях ацилирования веществ А и Б:
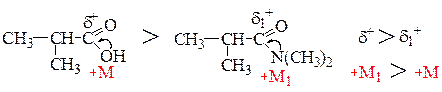
Пример решения задачи 28
Для решения схемы превращений необходимо знать не только химические свойства, но и способы получения карбоновых кислот.
|
|
|


