 |
Способы получения карбоновых кислот
|
|
|
|
1) Жесткое окисление углеводородов проводится следующими окислителями: KMnO4+H2SO4; K2Cr2O7+H2SO4; CrO3+CH3COOH и в общем случае может обозначаться символом [О].

2) Окисление первичных спиртов и альдегидов приводит к образованию карбоновых кислот с тем же углеродным скелетом. При действии на первичные спирты 1 моль окислителя образуется альдегид, а затем при действии второго моля окислителя - кислота:
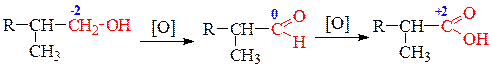
3) Гидролиз функциональных производных карбоновых кислот
4) Гидролиз тригалогенозамещенных углеводородов приводит к образованию неустойчивых геминальных триолов, которые самопроизвольно отщепляют молекулу воды, превращаясь в карбоновые кислоты:

5) Метод Гриньяра - взаимодействие магнийорганических соединений (реактивов Гриньяра) с углекислым газом. При присоединении реактивов Гриньяра к карбонильной группе углерод(II)-оксида образуются соли карбоновых кислот, из которых путем подкисления получают сами кислоты:

Решение
Заполним схему превращений, назовем промежуточные и конечные продукты.
| Вариант | Схема превращений |
| х | 
|

Пример решения задачи 29
С помощью качественных реакций различим между собой бутан-2,3-диол, метилизобутилкетон, 2-оксопропановую кислоту. Составим план эксперимента в виде приведенной ниже таблицы. Запишем уравнения использованных реакций, опишем наблюдаемый результат.
| Опыт | Реагент | Наблюдаемый результат и вывод | ||
| вещество А | вещество Б | вещество В | ||
| NaHCO3 I2, NaOH Cu(OH)2 | Без видимых изменений Без видимых изменений Растворение осадка с образованием темно-синего раствора - вицинальный спирт | Без видимых изменений Выделение желтого осадка с характерным запахом - метилкетон Без видимых изменений | Выделение пузырьков газа - карбоксильная группа Выделение желтого осадка с характерным запахом - метилкетон Растворение осадка с образованием голубого раствора - карбоновая кислота | |
| Общий вывод | бутан-2,3-диол
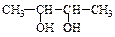
| метилизобутил-кетон
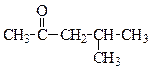
| 2-оксопропановая кислота

|
|
|
|
Запишем уравнения соответствующих реакций.
Опыт 1.
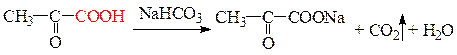
Опыт 2.

Опыт 3.

Пример решения задачи 30
Установите строение соединения с молекулярной формулой А, которое соответствует приведенному в таблице описанию. Обоснуйте выбор структурной формулы, сделав вывод по каждому из пунктов описания свойств. Назовите установленное вещество, напишите все упомянутые в условии уравнения реакций.
| Вариант | Молекулярная формула соединения А | Описание свойств соединения А |
| х | С10Н12О3 | а) сгорает с большим выделением копоти; б) не растворяется в щелочи при комнатной температуре, но при нагревании гидролизуется с образованием соли карбоновой кислоты и этанола; в) реагирует с металлическим натрием с выделением газа; г) при жестком окислении образует вещество состава С10Н10О4 с согласованной ориентацией заместителей в SE -реакциях |
Решение
| Экспериментальный факт | Выводы о строении |
| С10Н12О3 а) сгорает с большим выделением копоти; б) не растворяется в щелочи при комнатной температуре, но при нагревании гидролизуется с образованием соли карбоновой кислоты и этанола; в) реагирует с металлическим натрием с выделением газа; г) при жестком окислении образует вещество состава С10Н10О4 с согласованной ориентацией заместителей в SE -реакциях | содержит две или три кислородсодержащие функциональные группы а) присутствует бензольное кольцо; б) не кислота и не фенол, так как не растворяется в щелочи; является сложным эфиром ароматической карбоновой кислоты и этанола; в) содержит спиртовую группу ОН; г) сложноэфирная и спиртовая группа находятся в мета -положении относительно друг друга |

|
|
|
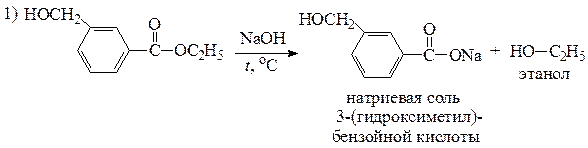
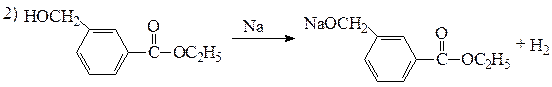
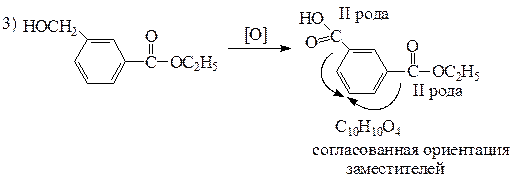
Пример решения задачи 31
1. Приведите формулу соединения D-псикоза, назовите его в соответствии с классификацией углеводов (например, кетотетроза). Запишите его аномерные формы в виде формул Хеуорса, укажите в них гликозидные гидроксилы. Сколько стереоизомеров можно построить для оксо- и циклической форм?
2. Приведите для соединения D-псикоза формулы энантиомера, диастереомера и эпимера. Дайте определение этим понятиям.
3. Для соединения D-псикоза напишите уравнения реакций с реагентами NH2NH2, HÅ; NaOH, H2O; ангидрид уксусной кислоты.
Для выполнения задачи рассмотрим классификацию, номенклатуру и химические свойства моносахаридов.
Углеводы - природные вещества, которые в соответствии с химической классификацией являются полиоксиальдегидами или полиоксикетонами, либо продуктами их конденсации.
Углеводы делят на 3 группы:
1) Моносахариды или монозы - не подвергаются гидролизу и не распадаются на более простые сахара. Примеры: глюкоза, фруктоза, ксилоза.
2) Олигосахариды - при гидролизе распадаются на несколько моносахаридов:
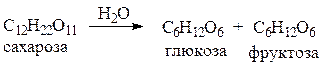
3) Полисахариды – высокомолекулярные вещества, распадающиеся при гидролизе на n молекул моносахаридов:

Моносахариды (монозы)
Классификация
1) В зависимости от числа атомов углерода в молекулемоносахарида различают триозы (три атома углерода), тетрозы, пентозы, гексозы, гептозы и т.д.
2) В зависимости от характера карбонильной группы (альдегидная или кетонная), моносахариды могут быть альдегидо- или кетоноспиртами. Моносахариды, содержащие альдегидную группу называются альдозами, кетонную группу – кетозами.
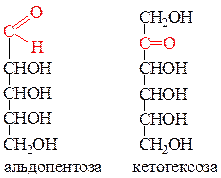
Большинство моносахаридов имеют тривиальные названия: ксилоза, рибоза, глюкоза, фруктоза и т.д. (см. табл. 49). Эти названия имеют суффикс «оза». Тривиальные названия применяют для названий по систематической номенклатуре производных этих углеводов. Например, рибоза: рибуроновая кислота, рибаровая кислота, рибит.
Немецкий химик Э.Фишер для изображения моносахаридов предложил проекционные формулы, которые отражают их пространственное строение. Атомы углерода, связанные с гидроксильными группами в формуле Фишера (кроме первичного –СН2ОН) не изображаются. Нумерация главной цепи начинается от атома углерода альдегидной группы либо с той стороны, где ближе находится кето-группа. Так как данные монозы содержат карбонильную группу, то называют такую форму изображения оксоформой.
|
|
|

Все монозы содержат асимметрические атомы углерода (при атоме углерода есть четыре разных заместителя) и существуют в виде нескольких оптических (пространственных) изомеров. Количество пространственных изомеров можно определить по формуле Фишера: N=2n, где n – число асимметрических атомов углерода. Например, в приведенной ниже монозе, ассиметрические атомы углерода обозначены звездочками. Количество таких атомов – 4. Следовательно, подставив в формулу Фишера данное число, получим количество пространственных изомеров – 16.

Для всех моноз установлены относительные конфигурации, т.е. пространственное расположение гидроксильных групп у асимметрических атомов углерода относительно конфигурации D-глицеринового альдегида.
Принадлежность моносахарида к тому или иному генетическому ряду определяется по конфигурации его последнего, считая от альдегидной группы, асимметрического атома углерода. Если она соответствует конфигурации D-глицеринового альдегида (группа - OH стоит справа от вертикальной линии), то моноза относится к D -ряду. Если группа - OH стоит слева, то соответствует конфигурации L-глицеринового альдегида, и моноза относится к L –ряду.

Пример:

Монозы, отличающиеся друг от друга конфигурацией лишь одного асимметрического атома углерода, называются эпимерами. Например: D-глюкоза и D-манноза.

Монозы, отличающиеся друг от друга конфигурацией нескольких асимметрических атомов углерода, называются диастереомерами. Например: D-глюкоза и D-талоза.

Монозы, которые имеют противоположную конфигурацию всех ассиметрических атовов углерода и относятся друг к другу как предмет к своему зеркальному изображению, называют энантиомерами. Например: D-глюкоза и L-глюкоза.
|
|
|

Хеуорс установил свойства моносахаридов, которые не объясняются предложенными выше оксоформами:
а) медленно реагируют с NaHSO3;
б) повышенная реакционная способность одной из ОН-групп;
в) наличие в 2 раза большего числа изомеров, чем предсказывает формула Фишера;
г) явление мутаротации.
Было установлено, что моносахариды могут иметь двоякое строение:
1) альдегидо- и кетоноспиртов - оксоформа
2) внутренних циклических полуацеталей – циклическая форма.
Последняя не содержит свободной альдегидной или кетонной групп, но легко может образовывать оксоформу путем разрыва цикла.
В кристаллическом состоянии моносахариды имеют циклическое строение, а в растворах могут быть циклическими и открытыми оксо-формами.
Для циклических форм моносахаридов принято их изображение в виде формул Хеуорса: пиранозная и фуранозная.

Циклическая форма моноз образуется при внутримолекулярном взаимодействии карбонильной группы и гидроксильной, связанной с пятым (С-5) или четвертым (С-4) атомами углерода. Данная реакция приводит к образованию простой эфирной связи и появлению новой гидроксильной группы. Эта группа называется полуацетальной или гликозидной.
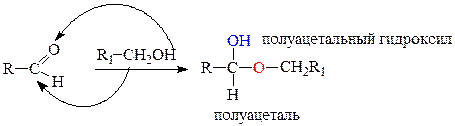
Взаимодействие карбонильной группы с гидроксильной при С-5 приводит к образованию шестичленного цикла: 5 атовов углерода и один атом кислорода. Следовательно, цикл образуется пиранозный.

Взаимодействие карбонильной группы с гидроксильной при С-4 приводит к образованию пятичленного цикла: 4 атова углерода и один атом кислорода. Следовательно, цикл образуется фуранозный.
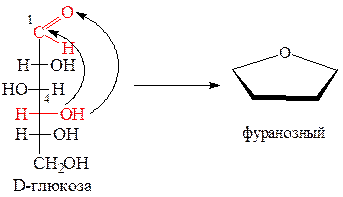
Пиранозный и фуранозный циклы изображаются в горизонтальной плоскости. Связи, расположенные ближе к наблюдателю изображают жирной линией. Атом кислорода в пиранозном цикле располагают в правом верхнем углу, а фуранозного – за плоскостью цикла в верхнем углу. Атомы углерода, которые находятся в цикле, не пишут. Нумерацию атомов углерода начинают от кислорода по часовой стрелке.

Гидроксильные группы располагают в цикле по определенному правилу: если гидроксильная группа при соответствующем углероде в оксо-форме (в проекции Фишера) находится слева от вертикальной линии, то в циклической форме ее изображают над плоскостью цикла при данном атоме углерода (вверх), и наоборот, справа - под плоскостью (вниз).
Положение полуацетального гидроксила в циклической форме определяет принадлежность монозы к одной из аномерных форм - α или β. Аномеры - диастереомеры, которые отличаются конфигурацией полуацетального гидроксила при атомах углерода С-1 (для альдоз) или С-2 (для кетоз). Для моноз D-ряда у α-аномера гидроксильная группа находится под плоскостью цикла, у β-аномера - над плоскостью. Для моноз L-ряда наоборот. Добавление еще одного дополнительного ассиметрического атома углерода для циклических форм моноз приводит к увеличению количества стереоизомеров в два раза. Например, для глюкозы в оксоформе количество стереоизомеров 16, в циклической - 32.
|
|
|

Приведем примеры образования циклических пиранозных и фуранозных формул Хеуорса для некоторых альдоз и кетоз.

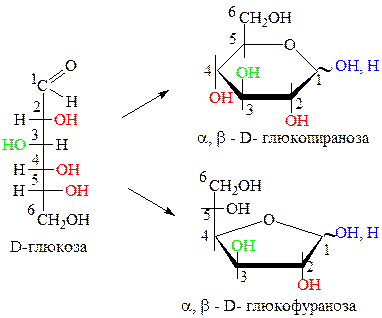

Названия циклических формул моносахаридов состоит из:

|
|
|


