 |
Лабораторные работы по полярографическому анализу
|
|
|
|
Общие указания к лабораторным работам по полярографическому и амперометрическому методам анализа
Современный полярограф является сложным электронным прибором, поэтому перед выполнением эксперимента необходимо:
а) внимательно ознакомиться с описанием прибора и инструкцией по его использованию (особое внимание следует обратить на управляющие ручки прибора отмеченные в тексте);
б) уяснить цель работы и порядок ее проведения;
в) рассказать преподавателю о порядке выполнения работы и функциях управляющих органов прибора;
г) получив разрешение преподавателя, включить прибор в сеть и подготовить необходимые растворы для проведения работы.
2. Электронные полярографические приборы питаются от сети переменного тока 220 В. Кроме того, для питания отдельных блоков прибора используется более высокое напряжение. Поэтому приборы должны быть хорошо заземлены. Используемые для подключения в сеть провода не должны иметь повреждений и должны быть хорошо изолированы. В процессе работы ртуть накапливается на дне электролизера. Необходимо помнить, что пары ртути являются опасным ядом для организма. Однако при тщательном выполнении инструкции и аккуратной работе возможность заражения воздуха лаборатории сводится к минимуму.
Запрещается
1. Использовать нагревательные приборы вблизи ртутных ячеек.
2. Оставлять открытую поверхность ртути в электролизере (всегда должен быть слой жидкости – воды или растворов).
3. Оставлять ртутный капающий электрод на воздухе, не подставив под капиляр стакан с водой или электролизер с раствором.
4. Работать с ртутью вне специального подноса (сюда же относятся все работы с электролизерами, где на дне имеется ртуть).
|
|
|
5. Сливать отработанные растворы в раковину.
Работать с ртутной ячейкой можно только на подносе. Все сливы растворов из электролизеров следует производить в специальные банки для слива, находящиеся на том же подносе. Промывание электродов производят дистиллированной водой из промывалки, подставив под электроды стакан.
При обнаружении капель ртути на подносе или при проливании ртути немедленно сообщить лаборанту или преподавателю для принятия соответствующих мер.
Лабораторная работа №1
Обнаружение ионов Cu2+, Cd2+, Zn2+,Mn2+
Цель работы: Получение полярографического спектра катионов. E1/2 идентифицировать наличие катионов.
На фоне аммиачного буферного раствора полярографические волны ионов, образующих аммиакаты, достаточно четко выражены и E1/2 существенно отличается.
Аппаратура и реактивы
Полярограф любой марки;
Электролизер;
Ртутный капающий электрод;
Насыщенный каломельный электрод;
Очищенный азот;
Градуированные пипетки вместимостью 10 мл;
Кристаллический сульфат натрия;
Фоновый электролит – аммиачный буферный раствор;
Стандартные растворы сульфатов кадмия, марганца, меди, цинка, 10-3 М;
Анализируемый раствор сульфатов солей, 10-3 М.
Порядок выполнения работы
Регистрируют полярограмму фонового электролита. Для этого в электролизер вносят 10 мл аммиачного буферного раствора, несколько кристаллов Na2SO3, перемешивают, опускают электроды, ячейку подключают к полярографу и регистрируют полярограмму при потенциалах –0,2…1,8 В.
Регистрируют полярограмму стандартных растворов: в электролизер вносят 10 мл аммиачного буферного раствора, 0,5 мл стандартного раствора CdSO4 и полярографируют как указанно выше. Аналогично полярографируют растворы MnSO4, CuSO4, ZnSO4.
Исследуемые растворы анализируют как стандартные растворы.
|
|
|
Полученные полярограммы обрабатывают графически и путем полулогарифмического графика (рис. 1) рассчитывают E1/2 и число электронов, участвующих в электродном процессе. Значения E1/2 для полярограммы неизвестного раствора сравнивают с найденными значениями E1/2 для стандартных растворов и табличными данными. Делают вывод о качественном составе анализируемого раствора.

Рисунок 1 – Определение потенциала полуволны (E1/2) непосредственно по экспериментальной полярограмме (а) и по уравнению полярографической волны (б).
Потенциал полуволны E1/2 является полярографической характеристикой; это потенциал, при котором достигается значение тока, равное половине диффузионного (рис. 1а). E1/2 не зависит от концентрации электроактивного вещества и является табличной величиной (см. таблицы потенциалов полуволн в справочниках по аналитической химии). Величина потенциала полуволны определяется, главным образом, величиной стандартного окислительно-восстановительного потенциала системы, соответствующей электродному процессу (например, Zn2+/Zn или Cd2+/Cd) и несколько изменяется с изменением ионной силы раствора. Необходимо учитывать,что в полярографии принято относить к значению потенциала насыщенного каломельного полуэлемента Eн.к.э.=0,2484 В. Наиболее точно значение E1/2 определяется из графика, на котором по оси абсцисс откладывают значение потенциала электрода, а по оси ординат – значения 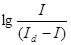 (см. рис. 1б). Потенциал соответствующий точке со значением
(см. рис. 1б). Потенциал соответствующий точке со значением 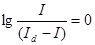 и является E1/2. Величина потенциала полуволны может существенно изменяться в том случае, если восстанавливающийся (или окисляющийся) ион связывается в комплексное соединение. В зависимости от устойчивости образующегося комплекса E1/2 в большей или меньшей степени сдвигается в сторону отрицательных значений потенциалов (например, E1/2 Zn2+/Zn=-0,99 В; E1/2 Cd2+/Cd=-1,43 В). В случае обратимых электродных процессов изменение потенциала полуволн при образовании комплексных соединений может быть использовано для определения величин констант устойчивости комплексов и координатного числа. Для практических целей сдвиг потенциала полуволн при комплексообразовании может быть использован для получения раздельных волн при снятии полярографических кривых в растворах, содержащих ионы с близкими значениями E1/2 (например Ti+, Pb2+ или Cu2+).
и является E1/2. Величина потенциала полуволны может существенно изменяться в том случае, если восстанавливающийся (или окисляющийся) ион связывается в комплексное соединение. В зависимости от устойчивости образующегося комплекса E1/2 в большей или меньшей степени сдвигается в сторону отрицательных значений потенциалов (например, E1/2 Zn2+/Zn=-0,99 В; E1/2 Cd2+/Cd=-1,43 В). В случае обратимых электродных процессов изменение потенциала полуволн при образовании комплексных соединений может быть использовано для определения величин констант устойчивости комплексов и координатного числа. Для практических целей сдвиг потенциала полуволн при комплексообразовании может быть использован для получения раздельных волн при снятии полярографических кривых в растворах, содержащих ионы с близкими значениями E1/2 (например Ti+, Pb2+ или Cu2+).
|
|
|
Контрольные вопросы
1. Особенности ячейки для полярографических исследований.
2. Почему вещество, участвующее в электродной реакции, называют деполяризатором?
3. Почему при регистрации полярограммы необходима высокая концентрация индифферентного электролита?
4. Какой вид имеет полярографическая волна? Какую информацию о качественном и колличественном составе можно получить, рассматривая ее?
5. Почему E1/2 характеризует природу деполяризатора?
Литература
1. Методическое пособие по физико-химическим методам анализа. Орел ГТУ, 2001.
2. Цитович И.К. Курс аналитической химии. – М.: Высшая школа, 1994.
3. Васильев В.П. Аналитическая химия, ч.2. Физико-химические методы анализа. М.: Высшая школа, 1994.
4. Дорохова Е.П., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
5. Практикум по физико-химическим методам анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
Лабораторная работа №2
Обнаружение ионов Pb2+, Tl2+
Цель работы: Получение полярограммы свинца и таллия. Определение содержания этих катионов по величине E1/2.
В кислых и нейтральных растворах полярографические волны восстановления ионов Pb2+ и Tl+ практически сливаются: в 1 М растворе HCl E1/2=-0,44 В для ионов свинца и E1/2=-0,48 В для ионов таллия. В щелочной среде на полярограмме смеси появляются две раздельные волны: свинец образует гидрокомплекс  , который восстанавливается при –0,16 В, незакомплексованные ионы Tl+ восстанавливаются при –0,49 В.
, который восстанавливается при –0,16 В, незакомплексованные ионы Tl+ восстанавливаются при –0,49 В.
Аппаратура и реактивы
Полярограф любой марки;
Электролизер;
Ртутный капающий электрод;
Насыщенный каломельный электрод;
Очищенный азот;
Градуированные пипетки вместимостью 10 мл;
Раствор нитрата калия;
Сухой гидроксид натрия;
Раствор желатина, 0,2%;
Анализируемый раствор сульфатов солей, 10-3 М Pb(NO3)2 и TlNO3.
Порядок выполнения работы
|
|
|
В электролизер вносят 10 мл фонового раствора KNO3, 0,2 мл анализируемого раствора, 3 капли раствора желатина. Продувают азот 5 минут и регистрируют полярограмму. Затем в этот же раствор вносят примерно 0,5 г NaOH и после растворения пропускают азот 50 минут. Вновь регистрируют полярограмму. Полярограммы обрабатывают графически и делают вывод о качественном составе раствора и возможности определения Pb2+ и Tl+ в смеси.
Контрольные вопросы
1. Какой вид имеет полярографическая волна?
2. Почему E1/2 характеризует природу деполяризатора?
3. При каких условиях предельный ток является диффузионным?
4. В каких случаях возможно одновременное определение нескольких деполяризаторов?
Литература
1. Методическое пособие по физико-химическим методам анализа. Орел ГТУ, 2001.
2. Цитович И.К. Курс аналитической химии. – М.: Высшая школа, 1994.
3. Васильев В.П. Аналитическая химия, ч.2. Физико-химические методы анализа. М.: Высшая школа, 1994.
4. Дорохова Е.П., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
5. Практикум по физико-химическим методам анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
Лабораторная работа №3
Обнаружение ионов Cd2+, Zn2+
Цель работы: Получение полярограммы катионов Cd2+, Zn2+. Определение методом стандартов концентрации Cd2+, Zn2+ в растворе по величине  и
и  .
.
Продуктом восстановления Cd2+, Zn2+ на ртутном капающем электроде является амальгама этих металлов. Потенциалы полуволн на фоне аммиачного буферного раствора различаются более чем на 0,5 В. Предельный диффузионный ток определяется уравнением Ильковича (26), поэтому концентрацию ионов этих металлов можно определить любым методом, например методом стандартов.
Аппаратура и реактивы
Полярограф любой марки;
Электролизер;
Ртутный капающий электрод;
Насыщенный каломельный электрод;
Очищенный азот;
Градуированные пипетки вместимостью 10 мл;
Кристаллический сульфат натрия;
Фоновый электролит – аммиачный буферный раствор;
Стандартные растворы сульфатов кадмия и цинка, 10-3 М;
Анализируемый раствор сульфатов кадмия и цинка, 10-3 М.
Порядок выполнения работы
В мерную колбу вместимостью 50 мл вносят пипеткой по 2,5 мл стандартного раствора CdSO4 и ZnSO4. Доводят раствор до метки аммиачным буферным раствором, перемешивают, наливают в электролизер, добавляют несколько кристаллов Na2SO3, перемешивают, опускают электроды, подключают ячейку к полярографу. Регистрируют полярограмму в области потенциалов –0,5…1,8 В. Обрабатывают полярограмму, определяя  и
и  , соответствующие концентрациям
, соответствующие концентрациям  .
.
|
|
|
В другую мерную колбу такой же вместимости вносят пипеткой 2.5 мл исследуемого раствора, доводят раствор до метки аммиачным буферным раствором, перемешивают, наливают в электролизер, опускают электроды и полярографируют так же, как стандартные растворы. На полярограмме определяют  и
и  при тех же значенияхE1/2, что и для стандартных растворов, учитывая разбавление, рассчитывают концентрацию ионов Cd2+, Zn2+ по формулам:
при тех же значенияхE1/2, что и для стандартных растворов, учитывая разбавление, рассчитывают концентрацию ионов Cd2+, Zn2+ по формулам:
 (8)
(8)
 , (9)
, (9)
где V – вместимость мерной колбы;
VCd и VZn – объемы исходных стандартных растворов.
Контрольные вопросы
1. Почему E1/2 характеризует природу деполяризатора?
2. Почему метод классической полярографии не позволяет определить концентрации веществ ниже 10-5 М?
3. Каковы основные отличия графитового (пластикового) электрода от капающего ртутного?
4. Какие вещества можно определить методом прямой вольтамперометрии?
5. Какой вид имеет полярографическая волна?
6. В каких случаях возможно одновременное определение нескольких деполяризаторов?
Литература
1. Методическое пособие по физико-химическим методам анализа. Орел ГТУ, 2001.
2. Цитович И.К. Курс аналитической химии. – М.: Высшая школа, 1994.
3. Васильев В.П. Аналитическая химия, ч.2. Физико-химические методы анализа. М.: Высшая школа, 1994.
4. Дорохова Е.П., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
5. Практикум по физико-химическим методам анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
Литература
1. Васильев В.П. Аналитическая химия, ч.2. Физико-химические методы анализа. М.: Высшая школа, 1994.
2. Основы аналитической химии. Под редакцией Золотова Ю.А. М.: Высшая школа, ч. 1, 2 1996.
3. Дорохова Е.П., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
4. Практикум по физико-химическим методам анализа/ Под ред. О.М. Петрухина. – М.: Химия, 1987.
5. Айвазов Б.В. Практическое руководство по хроматографии М. Высшая школа, 1968.
6. Васильев В.П., Морозов Р.П., Кочерина А.А. Практикум по аналитической химии. М. «Химия», 2000.
|
|
|


