 |
Свойства ковалентной связи
|
|
|
|
Энергия связи – мера прочности химической связи, количество энергии, выделяющееся при образовании химической связи.
Любая химическая связь образуется с выделением энергии, для ее разрыва требуется затратить энергию, равную энергии связи.
Длина химической связи – это расстояние между центрами ядер атомов в молекуле, когда силы притяжения между атомами уравновешены силами отталкивания и энергия системы минимальна.
Кратность (порядок) связи – это число общих электронных пар, участвующих в образовании связи.
Насыщаемость − способность атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей.
Направленность связи показывает, в каком направлении смещается электронная плотность связи. Обычно это происходит от менее электроотрицательного атома к более электроотрицательному. Это параметр, определяющий пространственную структуру молекул, их геометрию, форму.
Полярность химических связей — характеристика, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах: Н+δ–Cl−δ. Полярность связи может быть выражена через ее дипольный момент μсв:

· Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковыми электроотрицательностями (молекулы состоят из атомов одного вида). В этом случае электронная плотность расположена симметрично между атомами: O2, Cl2, N2.
· Полярная ковалентная связь возникает в том случае, если частица образована атомами с различными электроотрицательностями (молекулы состоят из различных атомов). В этом случае электронная плотность смещена в сторону одного из атомов: НСl, Н2О, NO.
|
|
|
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а также наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
Поляризуемость связи – выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер. По поляризуемости π-связь значительно превосходит σ-связь, так как максимум электронной плотности π-связи располагается дальше от связываемых ядер.
Теория гибридизации
Гибридизация – это усреднение АО центрального атома по форме и энергии перед химическим взаимодействием, что приводит к образованию гибридных орбиталей, направленных в сторону образующейся связи. Число гибридных АО равно числу участвующих в гибридизации исходных АО.
sp 3-гибридизация: одна s + три р ® четыре sp 3.

Оси sp 3-гибридных орбиталей направлены к вершинам правильного тетраэдра, и валентный угол (угол между осями орбиталей) соответствует такому пространственному их расположению и составляет 109°28¢.

sp 2 – гибридизация: одна s + две р ® три sp 2.

Оси sp 2-гибридных орбиталей лежат в одной плоскости и направлены под углом 120° друг к другу.

sp- гибридизация: одна s + одна р ® две sp.

Оси sp 2-гибридных орбиталей находятся под углом 180°, то есть лежат на одной прямой. Это ещё менее вытянутые орбитали, чем sp 2 - гибридные.
|
|
|

Если на валентных подуровнях атома часть орбиталей полностью заполнена, эти АО тоже участвуют в гибридизации. Так гибридизуются валентные орбитали атома азота в аммиаке и атома кислорода в воде.


Каждому виду гибридизации АО соответствует определенная геометрическая форма молекулы:
| Вид гибридизации | Число связей | Валент ный угол | Конфигурация орбиталей | Примеры |
| Sp | АВ2 | 1800 | линейная 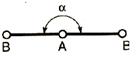
| H–Be–H, |
| sp2 | АВ3 | 120o |  плоская треугольная плоская треугольная
| BCl3; |
| sp3 | а) АВ4; б) АВ3; в) АВ2. | а)109,5o б)107,50 в) 104,50 |  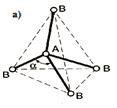  тетраэдрическая тетраэдрическая
| а) CH4; б) NH3; в) Н2О. |
| sp2d | 90o |  плоская квадратная плоская квадратная
| [Ni(CN)4]2–, [PtCl4]2– | |
| sp3d | АВ5 | α=90o; β = 120o |  тригонально-
бипирамидальная тригонально-
бипирамидальная
| PCl5 |
| sp3d2 | АВ6 | 90o |  октаэдрическая октаэдрическая
| [CoF6]3–, SF6 |
Вопросы для самоконтроля
1. Что такое химическая связь? Какие типы химической связи Вы знаете?
2. Метод валентных связей. Основные положения метода.
3. Как образуется ковалентная химическая связь? Какие способы её образования Вы знаете? Приведите соответствующие схемы и примеры.
4. Какие атомы или ионы называют донорами и акцепторами электронных пар? Приведите примеры.
5. Валентность. Максимальная валентность. Валентно-насыщенное и валентно-ненасыщенное состояние атома (на примере элементов II периода).
6. Какими свойствами обладает ковалентная связь?
7. Направленность химической связи. Влияние направленности связи на пространственную конфигурацию молекул типа АА, АВ, А2В, А3В. Насыщаемость, кратность связи длина и энергия связи.
8. Полярность и поляризуемость химической связи. Дипольный момент связи (постоянный и индуцированный). Полярная и неполярная ковалентная связь.
9. Какую ковалентную связь называют σ-связью и какую π-связью? Ответ разберите на конкретных примерах.
10. Что такое гибридизация атомных орбиталей?
11. Какие типы гибридизации являются наиболее важными? Сколько гибридных орбиталей образуется в результате: sp-, sp2-, sp3- гибридизации?
12. Что такое степень окисления элемента в соединениях с полярной ковалентной связью? Ионная связь как предельно поляризованная ковалентная связь. Гомо- и гетеролитический разрыв связи.
|
|
|
13. Водородная связь. Механизм образования водородной связи. Межмолекулярная и внутримолекулярная водородная связь.
Задания для самоконтроля
1. Дайте определения следующим понятиям:
Химическая связь –
Степень окисления —
Валентность –
Водородная связь –
Энергия связи –
Направленность связи –
Насыщаемость связи –
Полярность связи –
Поляризуемость –
2. Дополните утверждения:
1. Химическая связь, осуществляемая за счет обобществления электронных пар – это_________________ связь.
2. Способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи, называется ___________________.
3. Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ____________ связью.
4. Расстояние между центрами атомов в молекуле называется _________________.
3. Выберите из списка вещества, содержащие только ковалентные полярные связи: NH4Cl, Al2O3, CH4, KNO2, Cr, P2O5, NH3, O2.
4. Напишите структурные формулы данных соединений. Выберите пару молекул, в которых число π-связей одинаково.
а) Cl2O7 и P2O5; б) CO2 и C2H2;
в) CH3COOH и CO2; г) H2SO4 и H3PO4.
5. Число σ-связей увеличивается в ряду:
а) этан, силан, хлорид фосфора (III);
б) гексафторид серы, серная кислота, азотная кислота;
в) этилен, хлорид мышьяка (V), угольная кислота;
г) хлорная кислота, серная кислота, оксид хлора (VII).
6. Полярность связи уменьшается в ряду:
а) NH3, PH3, AsH3; в) H2O, SiH4, CH4;
б) HBr, HCl, HF; г) H2S, H2Se, H2O.
7. Укажите, у каких из ниже приведенных молекул химические связи имеют полярный характер:
F2, CO, N2, HBr, Вr2.
8. Дипольные моменты молекул BF3 и NF3 равны соответственно 0 и 0,2D. Объясните причины неполярности первой и полярности второй молекул.
9. Используя значения относительных электроотрицательностей атомов, расположите указанные соединения в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему?
| а) | NH3, PH3, AsH3, SbH3; |
| б) | BeF2, MgF2, CaF2, BaF2; |
| в) | CF4, NF3, OF2, F2; |
| г) | N2O, NO, NO2, N2O4. |
10. Энергия связи уменьшается в ряду:
|
|
|
а) хлорид углерода (IV), хлорид сурьмы (III);
б) хлорид мышьяка (III), хлорид фосфора (III);
в) хлорид олова (IV), хлорид фосфора (V);
г) хлорид ванадия (III), хлорид бора (III).
11. Длина связи уменьшается в ряду:
а) BH3, CH4, NH3 ; в) HF, HBr, HI;
б) SiH4, HCl, H2S; г) H2O, PH3, HCl.
12. Используя электронно-графические формулы определите валентности йода и фосфора в основном и возбужденном состояниях.
13. Определите степень окисления и валентность атома углерода в приведенных соединениях:
CH4; CH3Cl; CH2Cl2; CHCl3; CCl4.
14. Для соединений H2SO4 и СО2
а) запишите структурные формулы;
б) определите число s- и p-связей в молекуле;
в) запишите электронные и электронно-графические формулы центрального атома в основном, и, если надо – в возбужденном состоянии;
г) определите тип гибридизации, геометрию молекул;
д) изобразите схемы перекрывания орбиталей.
15. Какие атомы элементов II периода могут быть донорами и акцепторами электронных пар? Чем это определяется? Возможна ли донорная или акцепторная функция для центрального атома в молекулах: BeF2, BF3, CF4, NH3, H2O, PCl5?
16. Заполните таблицу:
| № | Частица | Геометрическая форма | Тип гибридизации АО | Пространственное изображение частицы | Количество s - и p - связей |
| BeF2 | Линейная | ||||
| BCl3 | sp2 | ||||
| BCl4- | |||||
| CF4 | 4 s | ||||
| CO2 | |||||
| H2O | 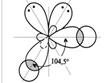
| ||||
| H3O+ | |||||
| GeF4 | |||||
| NOF |
17. С позиций метода валентных связей покажите образование предложенных молекул. Какие орбитали соединяющихся атомов участвуют в образовании связей? Сколько σ- и π-связей содержат молекулы? Какова пространственная структура каждой молекулы? Каков тип гибридизации атомных орбиталей центрального атома (если есть)? Отметьте полярность связей и полярность молекулы в целом.
а) N2; б) AsH3; в) COCl2; г) H2Se.
18. С позиций метода валентных связей объясните механизм образования молекулы SiF4 и иона SiF62-. Может ли существовать ион СF62-.
|
|
|


