 |
Задания для самоподготовки
|
|
|
|
1. Дайте определения:
Комплексное соединение –
Лиганды –
Комплексообразователь –
Комплексон –
Комплексонат –
2. Заполните пропуски в тексте, вписывая недостающие слова:
а) Комплексное соединение обычно состоит из внутренней и внешней____________. Внутреннюю _________ образует комплексообразователь - атом или ____________. Во внутренней _________ находятся отрицательно заряженные ионы или ___________. Число лигандов во внутренней сфере зависит от______________________ числа комплексообразователя. Но оно зависит и от такой характеристики лиганда, как______________. Она показывает, сколько координационных мест может занимать лиганд, образуя связи с комплексообразователем. Внешнюю сферу образуют ионы, число которых зависит от ____________________внутренней сферы.
 б) На этой схеме показано строение комплексного_________________. Судя по схеме координационное число равно______________, а дентатность каждого____________равна______________. Если частицы А - это однозарядные отрицательные ____________, то данное соединение _______________ комплексное соединение, и заряд внутренней сферы равен_______________.
б) На этой схеме показано строение комплексного_________________. Судя по схеме координационное число равно______________, а дентатность каждого____________равна______________. Если частицы А - это однозарядные отрицательные ____________, то данное соединение _______________ комплексное соединение, и заряд внутренней сферы равен_______________.
3. Дайте названия следующим комплексным соединениям: [Cu(NH3)4]SO4, K4[Fe(CN)6], [Cr(CO)6], Н2[PtCl6], K[ReF7], Ba[Cr(NH3)2(SCN)4]2, [Pt(NH3)2Cl2], [Co(NH3)4(H2O)Cl]Cl2, K[Cr(C2O4)2(H2O)2].
4. Установите соответствие:
| Комплексное соединение | Координационное число | Заряд внутренней сферы | |||
| Хлорид диамминсеребра | А | а | -1 | ||
| Нитротетрахлороаммин-кобальтат (III) аммония | Б | б | -2 | ||
| Гидроксотрифторо-беррилат галия (III) | В | в | |||
| Оксалатохлоротриаква-кобальт (III) | Г | г | +1 |
5. Заполните таблицу:
| Структурный элемент | Комплексное соединение | |||
| [Pd(H2O)(NH3)2Cl]Cl | K2[Zn(CN)4] | [Co(NH3)4SO4] | [Fe(CO)2(NO)2] | |
| Внешняя сфера | ||||
| Внутренняя сфера | ||||
| Комплексо- образователь | ||||
| Лиганды | ||||
| КЧ | ||||
| Дентатность | ||||
| Название | ||||
| Тип КС |
|
|
|
6. Составьте формулы возможных координационных соединений, если известен комплексообразователь Cr3+ (КЧ = 6), возможные лиганды и ионы внешней сферы: NH3, H2O, Cl-, K+.
7. Заполните пропуски в таблице:
| Параметр | Комплексное соединение | |||
| [Ag(NH3)2]- | [BF4]- | [Fe(CN)6]3- | [Cu(H2O)4]2+ | |
| Заряд комплексо- образователя | 3+ | |||
| КЧ | ||||
| Тип гибридизации орбиталей центрального атома | sp2d | |||
| Графическое изображение расположения связей | 
| |||
| Конфигурация комплекса | квадратно-плоскостная |
Какая химическая связь называется координационной или донорно-акцепторной? С позиций метода валентных связей разберите строение двух комплексных ионов из данного задания. Укажите донор и акцептор.
8. Константа нестойкости комплексного иона [Ag(NH3)2]+ равна отношению:
а)  б)
б) 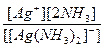
в) 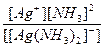 г)
г) 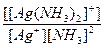
д)  е)
е) 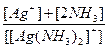
9. Напишите уравнения первичной и вторичной диссоциации следующих комплексных соединений: [Ag(NH3)2]OH, Na2[Be(OH)4], [Co(NH3)4SO4]Br, [Pt(H2О)2Cl2]. Запишите выражения констант нестойкости для каждой ступени и выражение общей константы нестойкости.
10. Расположите ионы в порядке возрастания их устойчивости:
| а) [HgCl4]2-, Кн = 8,5·10-15; б) [HgI4]2-, Кн = 1,5·10-30; | в) [Hg(CN)4]2-, Кн = 4·10-42; г) [HgBr4]2-, Кн = 1·10-21. |
11. Первая и вторая ступенчатые константы нестойкости комплексного иона [Ag(S2O3)2]3- соответственно равны: Кн1=2,0·10-5; Кн2=1,5· 10-9. Общая константа нестойкости рассматриваемого комплексного иона окажется равной
| а) 3,3·1013; б) 2,9·10 14; в) 3,0·10 -13; | г) 3,0·10 -14; д) 3,5·10 -14; е) 3,0·10 -45; |
12. Из раствора соли PtCl4·6NH3 нитрат серебра осаждает весь хлор в виде хлорида серебра, а из раствора соли PtCl4·3NH3 – только ¼ часть входящего в её состав хлора. Напишите координационные формулы этих солей и дайте им названия. Как будут диссоциировать эти вещества в растворе?
|
|
|
13. Концентрация ионов [Cu+] в 0,01 М растворе К[Сu(CN)2], содержащем 0,1 моль/л избыточного KCN, равна 1,0·10-6 моль/л. Константа устойчивости комплексного иона [Сu(CN)2]– составит:
| а) 1,0·10-7; б) 1,0·10-6; в) 1,0·10-5; | г) 1,0·105; д) 1,0·106; е) 1,0·107; |
14. Существует два координационных соединения кобальта с одинаковой эмпирической формулой CoBrSO4·5NH3. Различия между ними проявляются в реакциях их взаимодействия в растворах с BaCl2 и AgNO3. Одна соль дает осадок только с хлоридом бария, а вторая – только с нитратом серебра. Напишите координационные формулы и дайте названия обеих солей, приведите уравнения их электролитической диссоциации.
15. Продукты химической реакции [Cu(NH3)4]SO4 + KCN(избыток) →
| а) CuSO4 б) Cu(CN)2 в) K2[Cu(CN)4] | г) (NH4)2SO4 д) NH3 е) NH4CN | ж) K2SO4 з) KOH и) KHSO4 |
РАЗДЕЛ II. ТЕРМОДИНАМИКА
Актуальность
Живые организмы являются открытыми термодинамическими системами, которые обмениваются с окружающей средой различными веществами и энергией. Все процессы жизнедеятельности в организме тесно связаны с изменением энергетического баланса в системе живой организм - окружающая среда, поэтому термодинамические расчеты широко используются в медицине. Это расчеты энергетических превращений в целом живом организме и отдельных его системах в покое и при совершении работы (например, при мышечном сокращении, проведении нервных импульсов, осмотической работе), определение эффективности биологических процессов и энергии связи биохимических соединений. Исследование живых организмов как открытых термодинамических систем в стационарных условиях вблизи термодинамического равновесия позволяет подойти к изучению таких процессов, как, например, активный и пассивный транспорт веществ через клеточные мембраны, возникновение биоэлектрических потенциалов, механизм сопряжения потоков в биологической системе.
Цель: приобрести системные знания об основных понятиях термодинамики, научиться производить термодинамические расчеты.
|
|
|
|
|
|


