 |
Классификация неорганических соединений
|
|
|
|
Простейшая классификация неорганических соединений включает следующие основные классы:
1. Простые вещества.
2. Оксиды.
3. Гидроксиды.
4. Соли.
Далее в пособии рассматриваются правила написания химических формул перечисленных классов неорганических соединений, их названия по Международной номенклатуре и важнейшие свойства.
Простые вещества
Простые вещества существуют в виде атомов и молекул состоящих из одинаковых атомов.
Все известные атомы химических элементов систематизированы в Периодической системе элементов Д.И. Менделеева, где для каждого элемента приведены следующие данные:
· Русское название элемента (может быть указано латинское название). Элементы принято обозначать химическими знаками (символами). Символ элемента состоит из первой буквы или первой и одной из следующих букв латинского названия элемента; первая буква всегда прописная, вторая - строчная. Например, латинское название водорода Hydrogenium, обозначение-«Н»; кислорлд-Oxygenium «О», алюминия—Aluminium-«Al»; железа-Ferrum-«Fe», цинка-Zinkum-«Zn» и т.д.
· Порядковый номер элемента равный заряду ядра атома элемента, который указывает, также, число электронов в атоме.
· Атомную массу.
· Могут быть приведены дополнительные данные: строение валентного электронного слоя, перечень стабильных изотопов и другие данные.
Информация о химическом элементе содержащаяся в ячейке Периодической системы элементов
|

Ряд элементов, чаще всего газы при нормальных условиях, образуют молекулы из одинаковых атомов: азот – N2, кислород - O2, водород - H2 – это тоже простые вещества
Оксиды
Оксидами называются соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
|
|
|
Такие соединения, получаемые прямым или косвенным путем, образуют металлы и неметаллы.
Все оксиды делятся на несолеобразующие и солеобразующие, а последние по своим свойствам подразделяются на три группы:
· Основные оксиды
· Кислотные оксиды
· Амфотерные оксиды
Основные оксиды – это оксиды, которые при прямом или косвенном взаимодействии с водой, образуют основания. Образование основных оксидов характерно, также, для элементов главных подгрупп первой и второй групп Периодической системы элементов. Образование основных оксидов характерно для элементов в низших степенях окисления, расположенных в побочных подгруппах (металлы) всех групп Периодической системы элементов.
Кислотные оксиды – это оксиды, которые при прямом или косвенном взаимодействии с водой, образуют кислоты. Образование кислотных оксидов характерно, также, для элементов расположенных в главных подгруппах с четвертой по седьмую групп Периодической системы элементов (неметаллы). Образование кислотных оксидов характерно для элементов в высших степенях окисления, расположенных в побочных подгруппах (металлы) всех групп Периодической системы элементов.
Оксиды неметаллов, которые не образуют кислот, а следовательно и солей, называются несолеобразующими оксидами. Примерами несолеобразующих оксидов являются: СО оксид углерода (II), N2O оксид азота (I), NO оксид азота (II) и др.
Амфотерные оксиды – это оксиды, которые при прямом или косвенном взаимодействии с водой, образуют основания, способные взаимодействовать и с кислотами и с основаниями. Сами амфотерные оксиды образуют соли как при взаимодействии с кислотными оксидами, так и с оксидами, обладающими основными свойствами.
| |||
 |
|
|
|
Если любой химический элемент Периодической системы элементов обозначить как «Э», то общая формула оксидов будет иметь вид ЭmOn, где m и n указывают число атомов каждого вида составляющих химическую формулу оксида.
При составлении химических формул соединений следует помнить, что в молекулах, а следовательно и в их формулах, не может быть свободных валентностей.
Пример. В соответствии с определением оксидов, атом кислорода имеет степень окисления –2, т.е. кислород в оксидах проявляет валентность равную 2. Он образует 2 химические связи с любым элементом, находящимся в положительной степени окисления. Если элемент имеет степень окисления +1, что принято обозначать как Э+1 , то его валентность равна 1. Графически валентность обозначают чертой отходящей от элемента «Э-». Атом кислорода имеет валентность равную двум, что графически изображается в виде «-О-». Если предположить, что один атом одновалентного элемента соединяется с одним атомом кислорода, то образовавшееся соединение имело бы вид «Э-О-». Такого соединения быть не может, поскольку у атома кислорода имеется свободная валентность. Реально существуют молекулы оксидов одновалентных элементов, имеющие следующий вид «Э-О-Э» (графическая формула), где свободные валентности отсутствуют. Эмпирические химические формулы оксидов одновалентных элементов имеют вид Э2О.
Аналогичные рассуждения для элементов находящихся в степени окисления +2 (двухвалентные), дают графическую формулу «Э=О», эмпирическую ЭО.
В Периодической системе элементов 8 групп, поэтому максимальная степень окисления, которую могут проявлять элементы +8 (валентность равна восьми).
В таблице 1 приведены все возможные формулы оксидов химических элементов, их графические и эмпирические формулы, а также примеры химических формул оксидов элементов и их названия по Международной номенклатуре.
Таблица 1 – Формулы окисидов
| Степень окисления элемента | Валентность элемента | Графическая формула оксида | Эмпирическая формула оксида | Примеры формул оксидов | Названия оксидов по Международной номенклатуре |
| +1 | Э-О-Э | Э2О | Na2O N2O | Оксид натрия Оксид азота (I)* | |
| +2 | Э=О | ЭО | CaO CO | Оксид кальция Оксид углерода (II) | |
| +3 | О=Э-О-Э=О | Э2О3 | Al2O3 N2O3 | Оксид алюминия Оксид азота (III) | |
| +4 | О=Э=О | ЭО2 | TiO2 CO2 | Оксид титана (IV) Оксид углерода (IV) | |
| +5 | 
| Э2О5 | N2O5 V2O5 | Оксид азота (V) Оксид ванадия (V) | |
| +6 | 
| ЭО3 | CrO3 SO3 | Оксид хрома (VI) Оксид серы (VI) | |
| Степень окисления элемента | Валентность элемента | Графическая формула оксида | Эмпирическая формула оксида | Примеры формул оксидов | Названия оксидов по Международной номенклатуре |
| +7 | 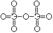
| Э2О7 | Mn2O7 Cl2O7 | Оксид марганца (VII) Оксид хлора (VII) | |
| +8 | 
| ЭО4 | RuO4 | Оксид рутения (VIII) |
|
|
|
*Валентность указывается только для элементов, которые могут иметь несколько значений валентности.
Как это видно из графических формул, в молекулах оксидов атомы кислорода связаны с атомами электроположительного элемента и не связаны друг с другом, равно как и атомы элементов не имеют связей друг с другом.
Многие элементы проявляют переменную валентность и образуют оксиды различного состава, что учитывается по международной номенклатуре указанием степени окисления элемента римскими цифрами, например Cr2O3 – оксид хрома (III), CrO3 – оксид хрома (VI).
Получение оксидов
Оксиды получают часто непосредственным взаимодействием простого вещества с кислородом или разложением сложных веществ:
C + O2 = CO2: 4Al + 3O2 = 2Al2O3
CaCO3 = CaO + CO2; Mg(OH)2 = MgO + H2O
Почти все оксиды элементов прямым или косвенным путем образуют с водой гидроксиды.
CO2+ H2O = H2CO3 Na2O + H2O = 2NaOH
Одни из них имеют характер кислот (Н2SО4, H2SO3, HNO3 и др.), другие — характер оснований (NaOH, КОН, Са(ОН)2 и др.), а третьи — двойственный характер и называются амфотерными гидроксидами (А1(ОН)3, Zn(OH)2, Cr(ОН)3 и др.). Продуктами гидратации амфотерных оксидов являются амфотерные гидроксиды, для которых возможны две формы записи гидратных форм:
для BeO – H2BeO2 или Be(OH)2 ;
для ZnO – H2ZnO2 или Zn(OH)2.
К амфотерным оксидам относятся Al2O3 , Fe2O3 , SnO, PbO, Cr2O3 и др.
Свойства оксидов
1. Отношение оксидов к воде:
a) основной оксид + вода = щелочь (оксиды щелочных и щелочно – земельных элементов)
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2
b) кислотный оксид + вода = кислота (исключение: оксид кремния SiO2)
|
|
|
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие между основными и кислотными оксидами: основной оксид + кислотный оксид = соль
MgO + SiO2 = MgSiO3
3. Взаимодействие между амфотерными и кислотными оксидами: амфотерный оксид + кислотный оксид = соль
ZnO + SO3 = ZnSO4
4. Взаимодействие между амфотерными и основными оксидами: амфотерный оксид + основной оксид = соль
Cr2O3 + Na2O = 2NaCrO2
5. Взаимодействие между основными оксидами и кислотами: основной оксид + кислота = соль + вода
BaO + 2HI = BaI2 + H2O
6. Взаимодействие между кислотными оксидами и основаниями: кислотный оксид + основание = соль + вода
CO2 + Ca(OH)2 = CaCO3 + H2O
Амфотерные оксиды
Амфотерные оксиды и их гидратные формы, т. е. амфотерные гидроксиды, являются соединениями двойственной функции. Особенностью их химического поведения является способность к солеобразованию как с кислотами, так и с основаниями; например, при взаимодействии с кислотами оксид цинка ведет себя как основной оксид, а гидроксид цинка — как основание:
ZnO + H2SO4 = ZnSO4 + H2O, Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
при взаимодействии со щелочами оксид цинка ведет себя как кислотный оксид, а гидроксид цинка — как кислота, которую для наглядности представим в виде H2ZnO2:
ZnO + 2NaOH = Na2ZnO2 + H2O, H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
или Zn(OH)2+2NaOH = Na2[Zn(OH)4] (в растворе).
Аналогичным образом ведут себя, например, оксиды алюминия А12О3 и хрома Сr2О3 и их гидратные формы А1(ОН)3 и Сr(ОН)з., которые образуют соли, как при действии кислот:
А12О2 + ЗН2SO4 = А12(SО4)3+ЗН2О,
2Al(ОН)3 +ЗН2SO4 = Al2(SO)3 + 6Н2O так и при действии щелочей:
А12O3 + 2NaOH = 2NaAlO2+H2O, Al (OH3) + NaOH = NaAlO2+2H2O
или А1(ОН)3 + NаОН = Nа[А1(ОН)4] (в растворе).
Химические свойства оксида определяются положением соответствующего элемента в Периодической системе Д. И. Менделеева. Известно, что в периодах металлические свойства элементов усиливаются справа налево, а в группах — сверху вниз: неметаллические свойства элементов изменяются в обратном направлении. На границе между элементами, оксиды которых имеют кислотный характер, и элементами, образующими основные оксиды, располагаются элементы, все оксиды которых амфотерны. Так, элементы, образующие амфотерные оксиды, располагаются на диагонали Н—Ge—Pb (на этой линии расположены элементы Н—Be—А1—Ge—Sn—Pb). Правее и выше этой линии, расположены элементы, образующие кислотные оксиды. Исключение составляют элементы V группы — мышьяк, сурьма, оксиды Э2O3 которых амфотерны (Э2O5— кислотные оксиды), и висмут, для которого оксид Э2О3 имеет основной характер.
Левее и ниже линии, соединяющей элементы с амфотерными оксидами, находятся элементы, образующие основные оксиды. Исключение составляют элементы III группы — Ga и In, оксиды которых амфотерны.
|
|
|
Амфотерными оксидами перечисленных выше элементов побочных подгрупп являются ZnO, Au2O3, Cr2O3, MnO2.
Если элемент образует оксиды в нескольких степенях: окисления, то амфотерные оксиды разделяют основные и кислотные так, что оксиды, соответствующие высшим степеням окисления, являются кислотными, а низшим — основными. Поэтому Сr2О3 — амфотерный, СrО3 — кислотный; МnО2 — амфотерный,: МnO3 и Мn2О7 — кислотные, а МnО— основной оксиды.
Перекиси
Кроме оксидов известны пероксиды или перекиси некоторых элементов, для которых характерна структурная группировка атомов кислорода —О—О—, наиболее известным представителем этого класса соединений является перекись водорода H2O2, в которой степень окисления кислорода равна –1, а валентность 2. Графическая формула перекиси водорода H-O-O-H.
Типовые задачи
Пример 1. Назовите оксиды по международной номенклатуре: Li2O, BaO, FeO.
Li2O – оксид лития.
Валентность лития может быть только 1 (степень окисления +1) поэтому не указывается.
BaO – оксид бария.
Валентность бария может быть только 2 (степень окисления +2) поэтому не указывается.
FeO – оксид железа (II).
Валентность железа может быть 2 и 3 (степень окисления +2 и +3) поэтому необходимо указывать. Чтобы указать валентность необходимо рассчитать степень окисления железа в FeO.
Заряд молекулы складывается из степеней окисления всех атомов и равен нулю:
0 = 1*х + 1*(-2), 0 = х – 2, х = +2, степень окисления железа равна +2 (валентность равна 2).
Пример 2. Привести графические и эмпирические формулы следующих оксидов: оксид алюминия, оксид азота (V), оксид серы (IV), оксид серы (VI).
Оксид алюминия. Алюминий является металлом третьей группы главной подгруппы ПСЭ, поэтому проявляет только валентность равную 3. Степень окисления в соединениях +3 (металлы могут иметь только положительные степени окисления).
Графическая формула

Эмпирическая формула Al2O3
Оксид азота (V).
Азот в этом соединении проявляет валентность 5 (степень окисления +5), что указано в названии.
Графическая формула

Эмпирическая формула N2O5
оксид серы (IV).
Сера в этом соединении проявляет валентность 4 (степень окисления +4), что указано в названии.
Графическая формула
О = S = О
Эмпирическая формула SO2
оксид серы (VI).
Сера в этом соединении проявляет валентность 6 (степень окисления +6), что указано в названии.
Графическая формула

Эмпирическая формула SO3
|
|
|


