 |
Химические свойства кислот
|
|
|
|
1. Кислота + активный металл = соль + водород
Mg + 2HCl = MgCl2 + H2
Азотная и концентрированная серная кислоты реагируют иначе.
2. Кислота + основной оксид = соль + вода
2HNO3 + CaO = Ca(NO3)2 + H2O
3. Кислота + основание = соль + вода (реакция нейтрализации)
H3PO4 +3LiOH = Li3PO4 + 3H2O
Растворы кислот изменяют цвет индикатора: лакмус - с фиолетового на красный, метиловый оранжевый - с оранжевого на розовый.
Типовые задачи
Пример 1. Назовите кислоту и ее анион, приведите ее графическую формулу H2SiO3.
Степень окисления кремния в кремниевой кислоте +4, следовательно, кремний образует 4 связи с атомами кислорода.
Эмпирическая формула H2SiO3 – кремниевая кислота.
SiO32- силикат ион
Графическая формула

Пример 2. Привести графические и эмпирические формулы азотистой кислоты и аниона этой кислоты. Назвать анион.
Эмпирические формулы:
HNO2, азотистой кислоты
NO2- нитрит ион
Графические формулы: H-O-N=O -O-N=O
Упражнения для самопроверки
1. Какие вещества называются кислотами?
2. Приведите названия следующих кислот и кислотных остатков (анионов): H2CO3, HNO3, CH3COOH, HNO2, H2S, HClO4, H3PO4, HCl, HMnO4, H2SO4, H2CrO4, HCOOH, H2SO3, H2Cr2O7.
3. Приведите эмпирические и графические формулы перечисленных кислот: а)хлорной; б) бромноватой; в) хлорноватистой; г) марганцовой; д) марганцовистой; е) серной; ж) сернистой; з) дисерной; и) хромовой; к) дихромовой; л) ортотеллуровой; м) ортоиодной; н) ортомышьяковой; о) метамышьяковой; п) метамышьяковистой; р) азотной; с) угольной; т) ортоборной.
4. Приведите названия и химические (эмпирические) формулы известных Вам бескислородных кислот.
5. Приведите названия и химические формулы известных Вам сильных кислот.
6. Приведите названия и химические формулы известных Вам слабых кислот.
|
|
|
7. Приведите примеры химических формул и названия одноосновных кислот.
8. Приведите примеры химических формул и названия двухосновных кислот.
9. Приведите примеры химических формул и названия трехосновных кислот.
СОЛИ
Солями называют химические соединения, состоящие из положительно заряженного иона, роль которого чаще всего выполняет ион металла, и аниона кислоты (отрицательно заряженный кислотный остаток).
Положительно заряженный ион (катион), входящий в состав соли, можно рассматривать как продукт, образующийся при отщеплении одной или нескольких гидроксогрупп от молекулы основания. Они могут быть простыми: К+ - ион калия, Mg+2 - ион магния, Al+3 - ион алюминия, они образуют средние соли, а могут быть сложными: MgOH+ - ион гидроксо магния, AlOH+2 - ион гидроксо алюминия или Al(OH)2+ - ион ди гидроксо алюминия, которые образуют основные соли.
Классификация солей
Соли классифицируются по многим признакам, но в настоящем пособии будут рассмотрены только средние, кислые и основные соли.
Кислотные остатки (анионы кислот) образуются при отщеплении одного или нескольких ионов водорода, заряд кислотных остатков всегда отрицательный. Они могут быть простыми: Cl- - ион хлора (анион хлороводородной кислоты), SO4-2 – сульфат ион (анион или кислотный остаток серной кислоты), PO4-3 – фосфат ион (анион или кислотный остаток фосфорной кислоты), простые анионы образуют средние соли, а могут быть сложными: HSO4- – гидро сульфат ион, HPO4-2 – гидро фосфат ион, H2PO4- – ди гидро фосфат ион, они образуют ряд кислых солей.
Таким образом, соли можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты ионами металла основания. При полном замещении атомов водорода кислоты, образуются средние соли, а при неполном – кислые соли.
H3PO4 + Al(OH)3 = AlPO4 + 3H2O средняя соль
3H3PO4 + 2Al(OH)3 = Al2(HPO4)3 + 6H2O кислая соль
3H3PO4 + Al(OH)3 = Al(H2PO4)3 + 3H2O кислая соль
|
|
|
Можно и наоборот, рассматривать соль, как продукт замещения гидроксидионов в молекуле основания кислотными остатками, тогда средние соли образуются при полном их замещении, а при частичном замещении образуются основные соли.
Al(OH)3 + H3PO4 = AlPO4 + 3H2O средняя соль
3Al(OH)3 + 2H3PO4 = (AlOH)3(PO4)2 + 6H2O основная соль
3Al(OH)3 + H3PO4 = [Al(OH)2]3PO4 + 3H2O основная соль
Средние соли
Средние соли состоят из катионов оснований и анионов кислот, которые не содержат ни ионов водорода, ни гидроксогрупп, способных к замещению. Например, соли К3РО4 и FeCl3 являются средними.
Чтобы правильно написать формулу какой-либо соли, следует учитывать степень окисления катиона (металла) и величину заряда (отрицательного) у аниона кислоты. Алгебраическая сумма зарядов анионов и катионов в молекуле соли должна быть равна нулю.
Таким образом, сульфат хрома, например, состоящий из ионов Gr+3 и SO4-2, имеет состав Gr2((SO4)3, а ортофосфат калия, состоящий из ионов К+1 и PO4-3, имеет состав К3РО4. Приведенные формулы солей называются эмпирическими или просто химическими формулами. На начальном этапе изучения классов неорганических соединений, в том числе для правильного составления формул, полезно начать с составления графических формул солей.
При изображении графической формулы соли следует опираться на графические формулы кислот, а точнее структуры аниона кислоты.
Отчетливо представляя себе структуры ионов SO4-2, ClO4-1, PO4-3 и др., например:
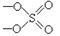


Сульфат ион Перхлорат ион Фосфат ион
Представляя графические формулы кислотных остатков и, зная степень окисления катиона, нетрудно изобразить графические формулы соответствующих солей. При этом необходимо помнить, что свободных валентностей (не присоединенных ни к одному атому химических связей – черточек) быть не может.
Графическая формула Al2(SO4)3 будет иметь следующий вид:

Число связей, образованных атомами алюминия, равно шести, поскольку степень окисления атома алюминия равна +3 (т.е. его валентность равна 3), а в состав молекулы входят два атома Al. Число связей, образованных сульфат ионами, также, шесть, поскольку заряд каждого аниона равен - 2, а в состав молекулы соли входят 3 кислотных остатка. Свободных валентностей нет. Далее следует проверить состав молекулы по виду и числу составляющих ее атомов и их валентностям.
|
|
|
 | |||
 | |||
Для Ca(ClO4)2 и Ba3(PO4)2. графические формулы будет иметь следующий вид,
Номенклатура солей
Соли могут быть названы разными способами, но необходимо уметь называть их по международной номенклатуре, которая в наибольшей степени отражает состав соли и позволяет по названию воспроизвести химическую формулу.
Название любой соли складывается из названия аниона в именительном падеже и названия катиона в родительном падеже, причем анион называется первым.
Если металл (катион соли) может проявлять несколько валентностей (степеней окисления), то валентность, проявляемую в данном соединении, указывают в скобках после названия катиона римскими цифрами.
Названия средних солей бескислородных кислот образуются от латинских названий кислотообразующих элементов, заканчивают суффиксом – ид, например: K2S - сульфид калия, NaCN- цианид натрия, CuCl2- хлорид меди (II).
Названия анионов кислородосодержащих кислот, а соответственно и солей, получают путем присоединения окончания и приставки в соответствии со степенью окисления кислотообразующего элемента. Высшей степени окисления «…ная» или «…овая» кислота (серная кислота, хромовая кислота) соответствует окончание «ат». Так, соли серной кислоты называются сульфатами, хромовой- хроматами и т.д. Более низкой степени окисления соответствует окончание «ит»; например, соли сернистой кислоты- сульфиты; азотистой - нитриты и т.д. Если существует кислота с еще более низкой степенью окисления кислотообразующего элемента («…оватистая» кислота), ее анион получает приставку «гипо…» и окончание «…ит»; так соли хлорноватистой кислоты HClO называют гипохлоритами.
Если молекула кислоты содержит два атома кислотообразующего элемента, то к названию аниона добавляют числительную приставку «ди…». Например, соли двухромовой кислоты H2Сr2O7 называются дихроматами (иногда бихроматами), соли двуфосфорной кислоты H4P2O7- дифосфатами.
|
|
|
Соли некоторых кислот в соответствии с исторически сложившейся традицией сохранили названия, отличающиеся от систематических. Так, соли марганцовой (HMnO4), хлорной (HClO4), йодной (HJO4) кислот называют соответственно перманганатами, перхлоратами, перйодатами. Аналогично, соли марганцовистой (H2MnO4), хлорноватой (HClO3), и йодноватой (HIO3) кислот носят названия манганатов, хлоратов и йодатов.
Названия важнейших кислот и солей приведены в таблице 3.
Таблица 3 – Названия важнейших кислот и солей
| Кислотообразующий элемент | Химическая формула | Название кислоты | Название солей |
| C+4 | H2CO3 | Угольная | Карбонаты, гидрокарбонаты |
| Si+4 | H2SiO3 | Кремниевая | Силикаты, гидросиликаты |
| N+3 | HNO2 | Азотистая | Нитриты |
| N+5 | HNO3 | Азотная | Нитраты |
| P+5 | H3PO4 | Ортофосфорная | Фосфаты, гидрофосфаты, дигидрофосфаты |
| S+4 | H2SO3 | Сернистая | Сульфиты, гидросульфиты |
| S+6 | H2SO4 | Серная | Сульфаты, гидросульфаты |
| Cr+6 | H2CrO4 H2Cr2O7 | Хромовая Дихромовая | Хроматы Дихроматы |
| Cl+ | HClO | Хлорноватистая | Гипохлориты |
| Cl+3 | HClO2 | Хлористая | Хлориты |
| Cl+5 | HClO3 | Хлорноватая | Хлораты |
| Cl+7 | HClO4 | Хлорная | Перхлораты |
| Mn+6 | H2MnO4 | Марганцовистая | Манганаты |
| Mn+7 | HMnO4 | Марганцовая | Перманганаты |
| Безкислородные кислоты | |||
| Cl- | HCl | Хлороводородная | Хлориды |
| Br- | HBr | Бромоводородная | Бромиды |
| Кислотообразующий элемент | Химическая формула | Название кислоты | Название солей |
| I- | HI | Иодоводородная | Иодиды |
| S-2 | H2S | Сероводородная | Сульфиды, Гидросульфиды |
| Органические кислоты | |||
| C+4 | HCOOH | Муравьиная | Формиаты |
| C+4 | CH3COOH | Уксусная | Ацетаты |
Кислые соли
Кислые соли содержат остатки кислот, имеющие ион водорода, способный к дальнейшему замещению на остаток основания, они образуются в результате неполного замещения водородных ионов кислоты ионами металла. Например, K2HPO4 и Ba(HCO3)2 – кислые соли.
Названия кислых солей образуют так же, как и средних, но при этом добавляют приставку «гидро», указывающую на наличие незамещенных атомов водорода, число которых обозначают греческими числительными (ди, три и т.д.).
Одноосновные кислоты не образуют кислых солей, поскольку их молекулы содержат только один ион Н+, способный замещаться ионом металла.
Двухосновные кислоты, такие, как H2SO4, H2SO3, H2CO3 и другие, образуют кислые соли, содержащие, соответственно, однократно отрицательно заряженные ионы HSO4-, HSO3-, HCO3-, называемые, соответственно, гидросульфат-, гидросульфит- и гидрокарбонат - ионами. Заряды этих ионов определяются как результат отрыва положительно заряженного иона Н+ от нейтральной молекулы той или другой кислоты по схеме:

Зная заряд иона, входящего в состав кислой соли, и иона металла нетрудно написать формулу кислой соли. Применительно к серной кислоте, кислые соли которой содержат ион HSO4-, формулы будут иметь следующий вид:
|
|
|
для однозарядных ионов – NaHSO4,KHSO4;
для двухзарядных ионов – Mg(HSO4)2, Zn(HSO4)2;
для трехзарядных ионов – Al(HSO4)3, Fe(HSO4)3.
Трехосновные кислоты, такие как H3PO4, H3AsO4 и некоторые другие, способны образовывать два типа кислых солей. В одном случае происходит замещение одного иона Н+ ионом металла, а два других иона Н+ входят в состав отрицательно заряженного иона кислотного остатка, образующего кислую соль.

Поскольку соли, содержащие ион H2PO4- или H2AsO4-, получены в результате замещения одного иона Н+ в молекуле кислоты ионом металла, они получили названия однозамещенных кислых солей или первичных кислых солей. Однозамещенные кислые соли для ионов различной степени окисления имеют следующие формулы и названия:
NaH2HO4 дигидроортофосфат натрия,
Ca(H2HO4), дигидроортофосфат кальция,
Al(H2PO4)3 дигидроортофосфат алюминия,
В другом случае происходит замещение двух ионов Н+ ионами металла, а третий ион Н+ входит в состав отрицательно заряженного иона HPO42- гидроортофосфатиона, образующего кислую соль:

Кислые соли, полученные в результате замещения двух ионов Н+ ионами металла, называются двухзамещенными кислыми солями, например,
Na2HPO4 - гидроортофосфат натрия,
CaHPO4 – гидроортофосфат кальция,
Al2(HPO4)3 – гидроортофосфат алюминия.
Основные соли
Основными называются соли, которые образуются в результате неполного замещения гидроксидных групп основания анионами кислот. Например, AlOHSO4, FeOHCl2- соли основные. В состав основных солей входит остаток основания, содержащий гидроксогруппу, способную к замещению на остаток кислоты.
Названия основных солей образуются подобно названиям средних солей, но при этом добавляют приставку «гидроксо…», указывающую на наличие незамещенных гидроксогрупп. Так FeOHCl- хлорид гидроксожелеза (II), (NiOH)2SO4- сульфат гидроксоникеля (II), Al(OH)2NO3- нитрат дигидроксоалюминия.
Однокислотные основания, например, такие как NaOH, KOH, AgOH и другие, не образуют основных солей, поскольку их молекулы содержат только один ион ОН-, способный замещаться анионом кислоты.
Двухкислотные основания (содержащие две гидроксогруппы способные к замещению), такие как Mg(OH)2, Cu(OH)2, Mn(OH)2 и другие, образуют основные соли, содержащие однократно заряженные катионы Mg(OH)+, Cu(OH)+, Mn(OH)+ и называемые соответственно гидроксомагний-, гидроксокупрум(II)- и гироксомарганец (II)-ионами.
Заряды этих ионов определяются как результат отрыва однократно отрицательно заряженного иона OH- от нейтральной молекулы гидроксида металла по схеме
Мg(ОН)2 ↔ ОН- + Мg (ОН)+
нейтральная отрицательно положително
молекула заряженный заряженый
ион ион
и представляют собой сочетание двукратно заряженного иона металла Ме+2 с ионом OH-.
Зная заряд иона, входящего в состав основной соли, а также заряд аниона нетрудно вывести формулу основной соли. Применительно к гидроксиду магния, основные соли которого содержат ион Mg(OH)+, формулы их имеют следующий вид:
для однозарядных анионов – Mg(OH)Cl, Mg(OH)NO3;
для двухзарядных анионов – (Mg(OH)2SO4, (Mg(OH)2CO3;
для трехзарядных анионов – (Mg(OH)3PO4,(Mg(OH)3AsO4;
Трехкислотные основания, такие как Al(OH)3, Gr(OH)3, Fe(OH)3 и другие, способны образовывать два типа основных солей. В одном случае происходит замещение одного иона ОН-
Al(OH)3 = Al(OH)2+ + OH-
а два других входят в состав однократно заряженного положительного иона Al(OH)2+, называемого дигидроксоалюминий-ионом. Основные соли алюминия этого типа, в зависимости от заряда аниона, характеризуются следующими формулами:
Al(OH)2NO3 - нитрат дигидроксо алюминия,
(Al(OH)2)2SO4 - сульфат дигидроксо алюминия,
(Al(OH)2)3PO4 - фосфат дигидроксо алюминия,
В другом случае происходит замещение двух ионов ОН-
Al(OH)3 = AlOH+2 + 2OH-
а третий ион ОН- входит в состав двукратно положительно заряженного гидроксоалюминий-иона. Основные соли алюминия этого типа будут иметь следующие формулы:
Al(OH)Cl2 – хлорид гидроксо алюминия,
AlOHSO4 – сульфат гидроксо алюминия,
(Al(OH)3(PO4)2 – ортофосфат гидроксо алюминия.
Как следует из приведенных примеров, названия основных солей слагаются из международных названий отрицательно заряженных ионов с указанием в родительном падеже положительно заряженных гидроксо – или дигидроксо - ионов.
Одним из условий, благоприятствующих образованию основных солей, является недостаточное количество кислоты по сравнению с тем, которое расходуется на образование средней соли. Так, при взаимодействии Al(OH)3 c H2SO4 уравнения образования основных солей и их графические формулы имеют следующий вид:

Получение солей
Соли можно получить различными способами, однако наиболее общими являются следующие:
1. Взаимодействие основания и кислоты (реакция нейтрализации). В зависимости от взятых соотношений реагентов могут образовываться средняя, кислые и основные соли.
3Fe(OH)2 + 2H3PO4 = Fe3(PO4)2 + 6H2O – фосфат железа (II).
Fe(OH)2 + H3PO4 = FeSrHPO4 + 2H2O – гидрофосфат железа (II).
Fe(OH)2 + 2H3PO4 = Fe(H2PO4)2 + 2H2O - дигидрофосфат железа (II).
3Fe(OH)2 + H3PO4 = (FeOH)3PO4 + 3H2O – фосфат гидроксо железа (II).
2. Основной оксид и кислотный оксид (солеобразующий) образуют соль без выделения других продуктов реакции.
CaO + CO2 = CaCO3 – карбонат кальция
3. Основной оксид (или амфотерный) и кислота при взаимодействии образуют соль, в которой элемент оксида является катионом, и воду
BaO + H2SO4 = BaSO4 + H2O – сульфат бария
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O – нитрат алюминия
4. Активные металлы, растворяясь в разбавленных кислотах (кроме азотной кислоты) образуют соль соответствующей кислоты, при этом выделяется водород.
Zn + 2HCl = ZnCl2 + H2 хлорид цинка
Fe + H2SO4 = FeSO4 + H2 сульфат железа (II)
Химические свойства солей
Важнейшими являются следующие свойства солей:
1. При растворении в воде соли практически полностью распадаются на катионы (положительно заряженные ионы металлов или более сложные образования) и анионы кислот. Этот процесс называется электролитической диссоциацией солей.
NaCl ® Na+ + Cl-
KHSO3 ® K+ + HSO3-
CuOHNO2 ® CuOH+ + NO2-
(NH4)2SO4 ® 2NH4+ + SO4-2
CH3COONa ® Na+ + CH3COO-
2. Термическое разложение солей. Некоторые соли при нагревании образуют оксиды (основной и кислотный).
CaCO3  CaO + CO2
CaO + CO2
3. Взаимодействие солей друг с другом. При определенных условиях (например, выделение осадка) соли взаимодействуют.
AgNO3 + KJ ® KNO3 + AgI¯
4. Менее активные металлы способны вытеснять более активные металлы из растворов их солей.
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Типовые задачи
1. Назовите следующие соли: а) Аl2(SO4)3, б) FеОН(NО3)2, в) KHS; г) FeCl2, д) NaH2PO4, е) AlOHSO4.
Решение
а) Аl2(SO4)3 сульфат алюминия, б) FеОН(NО3)2 нитрат гидроксожелеза {III}, в) KHS гидросульфид калия, г) FeCl2 хлорид железа {II}, д) NaH2PO4 дигидрофосфат натрия, е) AlOHSO4 сульфат гидроксоалюминия.
2. Приведите эмпирические и графические формулы следующих солей: фосфат калия, гидрокарбонат магния, карбонат гидроксокальция, дигидрофосфат титана {II}, сульфат дигидроксо титана {IV}.
Решение
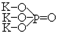 |
фосфат калия K3PO4
 |
гидрокарбонат магния Mg(HCO3)2
карбонат гидроксокальция (CaOH)2CO3

дигидрофосфат титана {II} Ti(H2PO4)2

 |
сульфат дигидроксотитана {IV} Ti(OH)2SO4
3. Составьте уравнения реакций между гидроксидом лантана (III) и кремниевой кислотой, приводящими к образованию следующих солей: La2(SiO3)3, La(HSiO3)3, LaOHSiO3, [La(OH)2]2SiO3. Приведите названия солей по международной номенклатуре.
Решение
2La(OH)3 + 3H2SiO3 = La2(SiO3)3 + 6H2O
силикат лантана (III)
La(OH)3 + 3H2SiO3 = La(HSiO3)3 + 3H2O
гидросиликат лантана (III)
La(OH)3 + H2SiO3 = LaOHSiO3 + 2H2O
силикат гидроксолантана (III)
La(OH)3 + H2SiO3 = [La(OH)2]2SiO3 + 2H2O
силикат дигидроксолантана (III)
|
|
|


