 |
Упражнения для самопроверки
|
|
|
|
1. Какие вещества называются основаниями?
2. Приведите названия следующих оснований: а)NaOH, б)Mg(OH)2, в)Cu(OH)2, г)CsOH, д)Ca(OH)2, е)Al(OH)3, ж)Zn(OH)2, з)Cr(OH)3, и)Ti(OH)4.
3. Приведите эмпирические и графические формулы перечисленных оснований: а) гидроксид калия; б) гидроксид циркония (IV): в) гидроксид бария; г) гидроксид галлия; д) гидроксид лантана (III); е) гидроксид лития; ж) гидроксид железа (II); з) гидроксид железа (III).
4. Приведите названия и химические (эмпирические) формулы известных Вам амфотерных гидроксидов.
5. Приведите названия и химические формулы известных Вам сильных оснований (щелочей).
6. Приведите названия и химические формулы известных Вам слабых оснований.
7. Приведите примеры химических формул и названия однокислотных оснований.
8. Приведите примеры химических формул и названия двухкислотных оснований.
9. Приведите примеры химических формул и названия трехкислотных оснований.
КИСЛОТЫ
Кислотами называются гидроксиды, которые при растворении в воде образуют ионы водорода (катионы) и ионы (анионы) кислотных остатков.
HCl = H+ + Cl¯
H2SO4 = 2H+ + SO4-2
Кислотными свойствами обладают гидроксиды неметаллов и некоторые металлы в высших степенях окисления. Перечень важнейших кислот приведен в таблице 2.
Таблица 2 – Перечень важнейших кислот, названия, эмпирические и графические формулы
| Формула | Степень окисления центрального атома | Название кислоты | Название аниона (соли) | Графическая формула |
| H3BO3 | +3 | Ортоборная | Ортоборат | 
|
| HBO2 | +3 | Метаборная | Метаборат | 
|
| H2CO3 | +4 | Угольная | Карбонат | 
|
| HNO3 | +5 | Азотная | Нитрат | 
|
| HNO2 | +3 | Азотистая | Нитрит | H-O-N=O |
| HF | -1 | Фтороводородная | Фторид | H-F |
| H2SiO3 | +4 | Кремневая | Силикат | 
|
| H3PO4 | +5 | Ортофосфорная | Ортофосфат | 
|
| H2SO4 | +6 | Серная | Сульфат | 
|
| Формула | Степень окисления центрального атома | Название кислоты | Название аниона (соли) | Графическая формула |
| H2SO3 | +4 | Сернистая | Сульфит | 
|
| H2S | -2 | Сероводородная | Сульфид | H-S-H |
| HCl | -1 | Хлороводородная | Хлорид | H-Cl |
| HClO | +1 | Хлорноватистая | Гипохлорит | H-O-Cl |
| HClO2 | +3 | Хлористая | Хлорит | H-O-Cl=O |
| HClO3 | +5 | Хлорноватая | Хлорат | 
|
| HClO4 | +7 | Хлорная | Перхлорат | 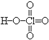
|
| HMnO4 | +7 | Марганцовая | Перманганат | 
|
| H2MnO4 | +6 | Марганцовистая | Манганат | 
|
| H2CrO4 | +6 | Хромовая | Хромат | 
|
| H2Cr2O7 | +6 | Двухромовая | Дихромат | 
|
| HCOOH | +4 | Муравьиная | Формиаты | 
|
| CH3COOH | +4 | Уксусная | Ацетаты | 
|
| Формула | Степень окисления центрального атома | Название кислоты | Название аниона (соли) | Графическая формула |
| H2C2O4 | +4 | Щавелевая | Оксалаты | 
|
|
|
|
Классификация кислот
1. По составу
· Кислородосодержащие: H2SO3, H2SO4, H3PO4, HNO3 и др.
· Бескислородные: НСl, HI, HBr, H2S, HCN и др. (не являются гидроксидами).
2. По силе:
· Сильные кислоты: НСl, HI, HBr, HNO3, H2SO4, HClO4, HMnO4
· Слабые кислоты – все остальные (H2S, HCN, H2SO3, H3PO4, и др.)
3. Основность кислоты, которая определяется числом атомов водорода способных замещаться при взаимодействии с основаниями.
· Одноосновные кислоты: НСl, HI, HBr, HNO3, HClO4, HMnO4, HCN, HCOOH, CH3COOH
· Двухосновные кислоты H2S, H2SO4, H2SO3, H2SiO3, H2CO3, H2C2O4
· Трехосновные кислоты H3PO4, H3AsO4, и др.
По Международной номенклатуре названия бескислородных кислот образуются из русского названия элемента (или группы атомов), образующего кислотный остаток, с добавлением соединительной гласной -о- и словосочетания –водородная кислота: HCl-хлороводородная кислота; HCN-циановодородная кислота, H2S-сероводородная кислота.
Названия кислородосодержащих кислот производится от названия неметалла с прибавлением окончаний – ная, -овая, если степень окисления неметалла равна номеру группы: H2SO4- серная, H3PO4- фосфорная, H2CrO4-хромовая. По мере понижения степени окисления центрального атома суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
|
|
|
HCl+7O4 –хлорная кислота
НСl+5O3 –хлорноватая кислота
HCl+3O2 – хлористая кислота
HClO – хлорноватистая кислота
Если элемент образует кислоты только в двух степенях окисления, то для названия кислоты, соответствующей низшей степени окисления центрального атома, используется суффикс -истая.
HN+5O3- азотная кислота
HN+3O2- азотистая кислота
Если элемент, находясь в одной и той же степени окисления, образует несколько кислот, содержащих по одному атому данного элемента в молекуле (например, HPO3 и H3PO4), то название кислоты, содержащей наименьшее число атомов кислорода, снабжается приставкой –мета, а название кислоты с наибольшим числом атомов кислорода – приставкой -орто.
HPO3 – метафосфорная кислота
H3PO4 – ортофосфорная кислота
Если молекула кислоты содержит два атома кислотообразующего элемента, то перед ее названием помещается числительная приставка – дву.
H4P2O7- двуфосфорная кислота
H2S2O7- двусерная кислота.
Получение кислот
1. Кислотный оксид + вода = кислота
B2O3 + 3H2O = 2H3BO3
N2O5 + H2O = 2HNO3
2. Получение бескислородных кислот (галогеноводородов)
H2 + Cl2 = 2 HCl газ
3. Соль слабой кислоты + сильная кислота = соль + слабая кислота
2KCl + H2SO4 = 2HCl + K2SO4
|
|
|


