 |
Опыт 1. Исследование зависимости скорости реакции от концентрации одного из взаимодействующих веществ.
|
|
|
|
ХИМИЯ
Журнал лабораторных работ
для студентов специалитета очной формы обучения специальности 08.05.01 Строительство уникальных зданий и сооружений
Москва
2019
Журнал лабораторных работ является основным отчетным документом студента при выполнении лабораторного практикума. Студенты распечатывают журнал и брошюруют его любым удобным способом.
К выполнению лабораторных работ допускаются студенты, изучившие правила техники безопасности и расписавшиеся в регистрационном листе. Результаты, полученные в процессе выполнения лабораторной работы, а также методики, схемы и общие выводы фиксируются в журнале. После полного и правильного оформления студентом лабораторной работы, выполнения им заданий для самостоятельной работы и защиты лабораторных работ преподаватель подписывает журнал.
Для студентов специалитета очной формы обучения специальности 08.05.01 Строительство уникальных зданий и сооружений
Оглавление
| Лабораторная работа № 1. Химическая кинетика и равновесие | 4 |
| Лабораторная работа № 2. Электролитическая диссоциация | 10 |
| Лабораторная работа № 3. Аналитическое определение жёсткости водопроводной воды | 14 |
| Лабораторная работа № 4. Гидролиз солей | 17 |
| Лабораторная работа № 5. Получение дисперсных систем. Определение поверхностного натяжения сталагмометрическим методом. | 21 |
| Лабораторная работа № 6. Окислительно-восстановительные реакции. | 26 |
| Лабораторная работа № 7. Металлы. Коррозия металлов. | 30 |
ЛАБОРАТОРНАЯ РАБОТА № 1
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Цель работы. Исследование зависимости скорости химической реакции от концентраций взаимодействующих веществ. Изучение смещения положения химического равновесия.
|
|
|
Опыт 1. Исследование зависимости скорости реакции от концентрации одного из взаимодействующих веществ.
В основе опыта лежит реакция:
Na2S2O3 + Н2SO4 = Na2SO4 + Н2О + SO2 + S
В три пробирки налейте из бюреток раствор тиосульфата натрия и дистиллированную воду в соответствии с данными, указанными в таблице. Это позволяет получить растворы с различными концентрациями тиосульфата натрия Na2S2O3, которые будут отличаться друг от друга на треть.
Затем в чистую пробирку налейте из бюретки раствор серной кислоты объёмом 2 мл.
Добавьте содержимое пробирки с кислотой в первый из растворов с тиосульфатом натрия, после чего сразу же встряхните смесь и отметьте время в момент смешивания растворов (с точностью до секунды), данные запишите в таблицу:
| № п.п. | Объём раствора Na2S2О3 (мл) | Объём воды (мл) | Время в момент смешива-ния растворов | Время в момент появления помутне-ния | Время реакции t (с) | Условная скорость реакции
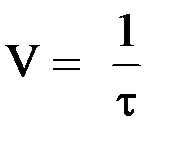 (с–1)
(с–1)
| Относи-тельная скорость реакции

|
| 1 | 2 + 4 | ||||||
| 2 | 4 + 2 | ||||||
| 3 | 6 + 0 | ||||||
Затем, во вторую и третью пробирки с раствором тиосульфата натрия добавляете по 2 мл серной кислоты, предварительно налитых в отдельную пробирку. Время в момент смешивания растворов записывайте в таблицу. Наблюдайте за растворами в пробирках, отметьте время в момент появления едва заметного помутнения раствора в каждой из них. Рассчитайте время и условную скорость реакции в каждом из случаев.
Напишите уравнение закона действия масс для данной реакции –
а) в общем виде: 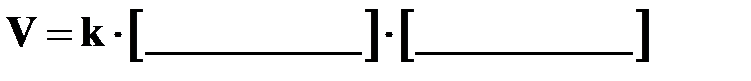
б) для конкретных условий опыта (постоянство концентрации H 2 S О4): 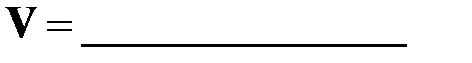
 По результатам опыта постройте график зависимости относительной скорости реакции от концентрации тиосульфата натрия. Для этого на абсциссе отложите число миллилитров раствора тиосульфата натрия, характеризуя этим его концентрацию (уже сделано), на ординате – величину относительной скорости.
По результатам опыта постройте график зависимости относительной скорости реакции от концентрации тиосульфата натрия. Для этого на абсциссе отложите число миллилитров раствора тиосульфата натрия, характеризуя этим его концентрацию (уже сделано), на ординате – величину относительной скорости.
|
|
|
Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Вывод_____ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________
Опыт 2. Влияние температуры на скорость химической реакции
В основе опыта лежит та же реакция, что и в опыте 1:
Na2S2O3 + Н2SO4 = Na2SO4 + Н2О + SO2 + S
Ваша задача – зафиксировать время появления опалесценции раствора при различных температурах, но одинаковых концентрациях реагирующих веществ.
Налейте в стаканы на 1/2 объёма воду: в первый стакан – водопроводную, во второй – смесь водопроводной и горячей (температура должна быть на 10оС выше, чем в первом стакане), в третий – горячую (температура на 10о выше, чем во втором стакане). В три пробирки наберите по 2 мл 1н раствора тиосульфата натрия и опустите по одной в стаканы.
Через 5 минут с помощью термометров замерьте температуру в стаканах. Не вынимая пробирку с тиосульфатом, добавьте в нее 1 мл раствора серной кислоты и измерьте время по секундомеру от момента добавления кислоты до появления легкой опалесценции. Повторите опыты с раствором тиосульфата и серной кислотой при двух других температурах. Произведите отсчет времени реакции по секундомеру, как и в первом случае. Результаты наблюдений внесите в таблицу.
| № наблюдения | Температура опыта, оС | Время течения реакции по секундомеру, t (с) | Скорость реакции, 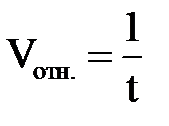 , (усл.ед.) , (усл.ед.)
|
| 1 | |||
| 2 | |||
| 3 |
Оформите результаты наблюдений в виде графика, откладывая на оси абсцисс температуру, а на оси ординат – относительную скорость реакции. Сделать вывод о влиянии температуры на скорость реакции, отметив, почему графическая зависимость от температуры не может выражаться прямой линией.

Вывод _________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
|
|


