 |
Способы управления радикально-цепными реакциями
|
|
|
|
В зависимости от того, какая реакция обрыва цепей преобладает, будет разной энергия активации, следовательно, меняется кинетика реакции. Таким образом, путем изменения стадии обрыва цепной реакции можно обеспечить более выгодные результаты. Это достигается за счет таких параметров, как температура, давление, продолжительность реакции, состав сырья.
Рассмотрим на примере процесса пиролиза способы управления радикально-цепным реакциями.
Пиролиз является совокупностью последовательных реакций, при которых целевые продукты (этилен и пропен - сырье нефтехимического синтеза) образуются при распаде как исходного сырья, так и первичных продуктов его разложения, и также подвергаются разложению. Поэтому важно обеспечить время реакции, соответствующее максимальному выходу целевого продукта. Пиролиз наиболее жесткий процесс термической переработки нефти. Он проводится при 700-1000оС и давлении близком к атмосферному.
Наилучшим видом сырья для получения алкенов являются алканы. При расщеплении н-алканов имеют место следующие закономерности: этан почти полностью превращается в этилен, из пропана и бутана с большим выходом образуются этилен и пропилен. При пиролизе изоалканов выход этилена меньше образуется больше газообразных алканов и в особенности метана. Арены при умеренных температурах являются балластом, а при более жестких условиях в значительной степени преобразуются в кокс и смолу.
Цепь при пиролизе зарождается за счет расщепления углеводорода по С-С связи. Образующийся радикал отрывает водород от исходного углеводорода, и далее цепь продолжается следующим образом:
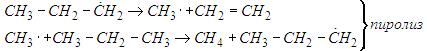
Рассмотрим термическое расщепление н-бутана.
|
|
|
Оно включает стадии зарождения, продолжения и обрыва цепи.
На стадии зарождения цепи должны появиться бутильные радикалы – первичный и вторичный.
СН3-СН2)-(СН2-СН3→2СН3-СН2∙
СН3)-СН2-СН2-СН3→СН3∙ + СН3-СН2-СН2∙
Пропильный и этильный радикалы склонны к распаду:
СН3-СН2-СН2∙→ СН3∙ + СН2=СН2
СН3-СН2∙→Н∙ + СН2=СН2
Низкомолекулярные радикалы СН3∙ и С2Н5∙, а также Н∙ активно вступают в реакцию с молекулами н-бутана с образованием первичного и вторичного бутильных радикалов:
СН3-СН2-СН2-СН3 + Н∙(СН3∙, С2Н5∙)→ СН3-СН2-СН2-СН2∙ + Н2(СН4, С2Н6)
СН3-СН2-СН2-СН3 + Н∙(СН3∙, С2Н5∙)→ СН3-СН2-С∙Н-СН3 + Н2(СН4, С2Н6)
Продолжение (развитие) цепи протекает по двум маршрутам путем превращения первичного и вторичного радикалов.
Первый маршрут:
СН3-СН2)-(СН2-СН2∙→СН3-СН2∙ + СН2=СН2
СН3-СН2∙→ Н∙ + СН2=СН2
СН3-СН2-СН2-СН3 + Н∙(С2Н5∙)→ СН3-СН2-СН2-СН2∙ + Н2(С2Н6)
СН3-СН2-СН2-СН3 + Н∙(С2Н5∙)→ СН3-СН2-С∙Н-СН3 + Н2(С2Н6)
Второй маршрут:
СН3)-(СН2-С∙Н-СН3 →СН3∙ + СН2=СН-СН3
СН3-СН2-СН2-СН3 + СН3∙→ СН3-СН2-СН2-СН2∙ + СН4
СН3-СН2-СН2-СН3 + СН3∙→ СН3-СН2-С∙Н-СН3 + СН4
Обрыв цепи:
2С2Н5∙→н-С4Н10 (рекомбинация)
2С2Н5∙→ СН2=СН2 + С2Н6 (диспропорционирование)
В реакциях обрыва не учтены реакции с участием Н∙ и СН3∙, так как они более реакционноспособны и, следовательно, менее стабильны, чем С2Н5∙, поэтому быстро вступают в реакции на стадии продолжения цепи.
Итоговые уравнения превращения н-бутана:
н-С4Н10→СН2=СН2 + С2Н6
н-С4Н10→СН2=СН-СН3 + СН4
н-С4Н10→2СН2=СН2 + Н2
Зная наиболее вероятные направления распада различных радикалов, константы скоростей продолжения и обрыва цепей, можно определить состав конечных продуктов. На современных пиролизных установках выход С2Н4 составляет порядка 35%.
Для пиролиза благоприятна высокая температура. Так при пиролизе пропана с повышением температуры растет выход пропилена и этилена. Увеличение температуры снижает селективность радикалов при реакциях замещения, что повышает образование первичных радикалов и снижает вероятность изомеризации первичных радикалов во вторичные, так как распад идет с большей энергией активации, чем изомеризация, и при увеличении температуры ускоряется в большей степени (Нормальные алканы при пиролизе дают наибольший выход этилена. У алканов изостроения показатели ниже, чем у неразветвленных). Температура 927оС при давлении 0,1 МПа близка к предельной температуре пиролиза, при которой достигается максимальный выход этилена. Выход пропилена достигает максимума при более низкой температуре, что позволяет регулировать соотношение этилена и пропилена в продуктах. Соотношение можно регулировать и изменяя время контакта.
|
|
|
Время пиролиза для достижения максимального выхода этилена должно обеспечить степень распада исходного сырья порядка 0,90-0,95, и тем меньше, чем выше температура пиролиза. Оно снижается от  1 с при 780-800°С до
1 с при 780-800°С до  0,1 с при 900-920 °С. Максимальный выход пропена при данной температуре пиролиза достигается при значительно меньшем (в 2-4 раза) времени реакции.
0,1 с при 900-920 °С. Максимальный выход пропена при данной температуре пиролиза достигается при значительно меньшем (в 2-4 раза) времени реакции.
В последние годы получил распространение пиролиз в жестких условиях (температура выше 800оС, время контакта 0,3-0,4 с), обеспечивающий высокий выход этилена. Подбор параметров процесса основан на кинетических расчетах. В справочниках имеются сведения о кинетических параметрах некоторых реакций пиролиза углеводородов.
Давление сильно влияет на пиролиз: при повышении давления содержание алкенов уменьшается, а содержание н-алканов и аренов увеличивается. Обычно давление на выходе из змеевика печи пиролиза составляет 0,03-0,12 МПа, однако желательно работать при еще более низком давлении. Чтобы снизить парциальное давление углеводородов, например, разбавляют сырье водяным паром. При этом значительно растет выход этилена, уменьшается коксообразование на стенках труб и увеличивается скорость движения газосырьевой смеси в печи.
|
|
|


