 |
Задание 2.Изучение зависимости скорости реакции от температуры.
|
|
|
|
Задание 2. Изучение зависимости скорости реакции от температуры.
В 3 пробирки наливают по 5 мл 0, 1 М раствора тиосульфата натрия, а в три другие – по 5 мл 1 М раствора серной кислоты. Помещают в стакан с водой при комнатной температуре 1 пробирку с раствором Na2S2O3 и пробирку с раствором H2SО4. Через 4-5 минут, измерив температуру воды в стакане, сливают вместе содержимое двух пробирок и фиксируют время. После помутнения раствора в пробирке также фиксируют время.
Путем добавления горячей воды добиваются, чтобы в стакане вода имела температуру на 10о больше, чем в первом случае. Вновь выдерживают растворы при этой температуре 4-5 минут, затем их сливают вместе и определяют время до начала появления мути.
Опыт с последней парой пробирок проводят при температуре приблизительно на 20о выше первоначальной (добавляя горячую воду в стакан).
Результаты записывают в таблицу по форме:
| to, C | 1/T | Время до появления мути, сек. | Условная скорость Vусл = 1/t | lgV |
Постройте график зависимости логарифма скорости реакций от обратной величины абсолютной температуры. Из графика определяют тангенс угла наклона и вычисляют энергию активации по формуле:
 ,
,
где a - угол наклона прямой относительно оси абсцисс.
По выполненным лабораторным работам сделайте вывод о влиянии концентрации реагирующих веществ и температуры на скорость реакции.
7. 3. 2. Задачи для самостоятельной работы.
1. Кинетические уравнения реакций различного порядка и периоды их полупревращения
| Порядок реакции | Дифференциальная форма уравнения реакции | Интегральная форма уравнения реакции | t0, 5 | Размерность t0, 5 |

| 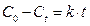
| 
| 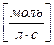
| |
| I | 
| 
| 
| 
|
| II | 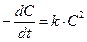
| 
| 
| 
|
|
|
|
2. Разбор типовой задачи
При 20оС константа скорости реакции равна 1× 10-4 мин-1, а при 50оС – 8× 10-4 мин-1. Чему равен температурный кэффициент скорости реакции?
Решение: Согласно правилу Вант-Гоффа:
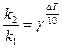 ,
,
Откуда  или
или  ;
;
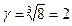
3. Задачи для самостоятельной работы
1. В результате некоторой реакции в единице объема в единицу времени образовалась 3, 4 г аммиака, а в результате другой реакции в тех же условиях – 3, 4 гфосфина. Одинаковы ли скорости этих реакций?
2. Как измениться скорость образования NO2 в соответствии с реакцией: 2NO + O2® 2NO2, если давление в системе увеличить в 3 раза, а температуру оставить неизменной?
3. Скорость некоторой реакции увеличивается в 2, 5 раза при повышении температуры на каждые 10о С в интервале от 0о до 60о. Во сколько раз увеличится скорость реакции при повышении температуры от 20о до 45о С?
4. Через некоторое время после начала реакции 3А+В®2С+D концентрация веществ составляли: [А]=0, 03 моль/л; [В]=0, 01 моль/л; [С]=0, 008 моль/л; [D]=0, 004 моль/л. Каковы исходные концентрации веществ А и В?
5. При 150о С некоторая реакция заканчивается за 16 минут. За какое время она закончится, если температурный коэффициент равен 2, 5: а) при 200о С; б) при 80о С?
6. Чему равна энергия активации реакции, если при повышении температуры от 290о до 300о К скорость ее увеличится в 2 раза.
7. Содержание витамина В15 в крови после инъекции изменяется следующим образом:
| Время, ч | |||||
| Содержание витамина, мг/мкл | 0, 42 | 0, 37 | 0, 22 | 0, 05 | Следы |
Определить период полупревращения витамина и константу скорости.
Задача решается графически.
8. Константа скорости реакции второго порядка H2(г) + J2(г)® 2HJ(г) при некоторой температуре равна 1, 25× 10-3  . Определите концентрации исходных веществ и скорость реакции через 2 минуты после ее начала, если начальная смесь состояла из реагентов с одинаковой концентрацией 1, 5 моль/л.
. Определите концентрации исходных веществ и скорость реакции через 2 минуты после ее начала, если начальная смесь состояла из реагентов с одинаковой концентрацией 1, 5 моль/л.
|
|
|
9. Гидролиз сахарозы в кислом растворе характеризуется энергией активации 107 кДж/моль. В присутствии фермента фруктофуранозидазы энергия активации снижается до 40 кДж/моль. Во сколько раз уменьшится период полупревращения при 310о К для каталитической реакции? Условно считать, что величина предэкспоненциального множителя не меняется.
|
|
|


