 |
Ферменты синтеза и превращений нуклеиновых кислот
|
|
|
|
ДНК-полимеразы. В бактериальных клетках содержится несколько ДНК-полимераз. ДНК-полимераза I была открыта первой в экстрактах Е. coli группой А. Корнберга (1956). Этот фермент катализирует полимеризацию нуклеотидов на одноцепочечной матрице. Для синтеза необходима ДНК-затравка (праймер). Полимеризация протекает путем присоединения мононуклеотидов к 3'-ОН-группе ДНК-затравки. Матрица определяет выбор ферментом нуклеотида соответственно правилам комплементарности: А спаривается с Т, Г — с Ц. Рост цепи происходит в направлении 5'→3'. ДНК-полимераза специфически нуждается в 5'-трифосфатах дезоксирибонуклеозидов, 5'-дифосфаты и 5'-монофосфаты неактивны. Неактивны также 5'-трифосфаты рибонуклеозидов. Для реакции требуются ионы Mg2+.
В процессе репликации ДНК синтетическая активность ДНК-полимеразы I играет вспомогательную роль — этот фермент «застраивает» бреши, образующиеся между фрагментами ДНК после удаления РНК-затравок. ДНК-полимераза I выполняет также функцию коррекции, т. е. отщепляет неправильно включенные в ДНК нуклеотиды. В этом случае фермент проявляет 3'→5'-экзонуклеазную активность.
ДНК-полимераза I играет важную роль в репарации, т. е. в устранении повреждений участков ДНК. В отличие от других ДНК-полимераз ДНК-полимераза I может вести синтез ДНК на матрице, имеющей несколько разрывов. Это связано с присущей ей 5'-3' - экзонуклеазной активностью: ДНК-полимераза I проводит отщепление ряда нуклеотидов, увеличивает размер бреши до величины, при которой она может служить «стартовой площадкой» для синтеза.
Важная роль принадлежит ДНК-полимеразе I в вырезании тиминовых димеров, образующихся в результате ультрафиолетового облучения клеток, и в застройке образовавшихся пробелов. Катализируя одновременно включение нуклеотида по З'-концу и удаление нуклеотида с 5'-конца, ДНК-полимераза I вызывает продвижение однонитевого разрыва вдоль молекулы ДНК. Такое перемещение разрыва или «трансляция ника» (от англ. nick — насечка), по-видимому, происходит и при репарации повреждений, возникающих в результате ультрафиолетового облучения клеток- Таким образом, роль в клетке ДНК-полимеразы I очень велика.
|
|
|
В клетках Е. coli содержится также ДНК-полимераза II. Роль ее сводится к восстановлению повреждений в участках молекулы ДНК. Если в ДНК существует пробел в 2—100 нуклеотидов, то ДНК-полимераза II заполняет его путем встраивания нуклеотидов с 3'-ОН-конца пробела. Если пробел больших размеров, то ДНК-полимераза II не может проводить репарацию, или проводит ее частично. Если в клетке отсутствует ДНК-полимераза I, то ДНК-полимераза II достраивает фрагменты ДНК, образующиеся при репликации ДНК.
В 1972 г. Т. Корнберг и сотрудники выделили из клеток Е. coli ДНК-полимеразу III. Она играет главную роль в репликации ДНК. Как и другие полимеразы, фермент проводит полимеризацию только в 5'-3'-направлении. Матрицей in vitro служит двухцепочечная молекула ДНК, имеющая большое число коротких пробелов и в связи с этим свободных З'-ОН-концов. Однако активный комплекс ДНК-полимеразы III с двумя специфическими белками в присутствии кополимеразы III работает только на длинной матрице. Активность ДНК-полимеразы III в 15 раз выше, чем ДНК-полимеразы /, и в 300 раз выше, чем ДНК-полимеразы II.
Эукариотические клетки, так же как и клетки Е. coli и других прокариот, содержат несколько ДНК-полимераз. В отличие от прокариотических, эукариотические ДНК-полимеразы не обладают экзонуклеазной активностью, поэтому они не могут выполнять функцию коррекции. Преобладающий фермент называется α-ДНК-полимераза. Особенно часто она встречается в быстро растущих клетках, осуществляет репликацию ядерной ДНК. Второй фермент — β-ДНК-полимераза — участвует в репарации ядерной ДНК, не встречается у низших эукариот (дрожжи, низшие растения). Третья — γ-ДНК-полимераза обнаружена в митохондриях. Она отличается от α- и β-ферментов по свойствам и, видимо, катализирует репликацию митохондриальной ДНК.
|
|
|
ДНК-зависимая РНК-полимераза. Все типы РНК в клетке — матричная, рибосомная, транспортная — синтезируются на матрице ДНК. Они образуются благодаря действию ДНК-зависимой РНК-полимеразы. Последовательность дезоксирибонуклеотидов цепи ДНК при этом транскрибируется, как бы переписывается буквами другого языка, поэтому сам процесс называется транкрипцией, в последовательность рибонуклеотидов в РНК.
Мононуклеотиды присоединяются по принципу комплементарности один за другим к З'-гидроксильному концу цепи РНК, цепь растет в направлении 5'→3', нуклеотиды связываются 3'→5'- фосфодиэфирными связями. Для реакции нужны все четыре вида рибонуклеозидтрифосфатов и ионы Mg или Мn. Хотя обычно матрицей служит двухцепочечная ДНК, транскрибируется одна ее цепочка, несущая антикодоновые последовательности, так что образующаяся мРНК содержит кодоны. Обычно копируется только определенный участок ДНК, кодирующий один определенный фермент или группу ферментов.
РНК-полимеразы найдены в животных, растительных и бактериальных клетках. Кроме транскрипционной РНК-полимеразы у Е. coli существует еще одна РНК-полимераза. Ее функция — синтез коротких РНК-затравок, необходимых для инициации репликации и синтеза фрагментов ДНК. В клетках прокариот обнаружены также мелкие РНК-полимеразы фагов. Они синтезируют мРНК, кодирующие фаговые белки, на матрицах ДНК фагов.
У всех эукариот, от дрожжей до млекопитающих, обнаружена система множественных РНК-полимераз. РНК-полимеразы эукариотических клеток выделены из тимуса теленка, культуры клеток человека, печени крысы и дрожжей. В каждом объекте обнаружено три различных фермента: высокомолекулярные белковые комплексы, содержащие сложный набор субъединиц. Все они являются ядерными ферментами.
РНК-полимераза 1 обнаружена в ядрышке и катализирует синтез рибосомных РНК. Этот фермент существует в двух формах, одна из которых состоит из 5—6 субъединиц, другая содержит на одну субъединицу меньше. РНК-полимераза II присутствует в нук-леоплазме, транскрибирует все гены эукариот, кодирующие белки, а также основные гены вирусов животных. Состоит из пяти субъединиц. РНК-полимераза III также локализована в нуклеоплазме, считается, что она отвечает за синтез 5S РНК и тРНК; состоит из 10 и более субъединиц. Молекулярная масса субъединиц перечисленных РНК-полимераз колеблется в широких границах.
|
|
|
Митохондрии эукариот имеют самостоятельный аппарат для матричного синтеза. Из них выделена самая простая из известных РНК-полимераз — мономер с М≈64 000.
Обратная транскриптаза. Необычное внимание привлекала к себе обратная транскриптаза, или ревертаза, или РНК-зависимая ДНК-полимераза. Она была обнаружена в составе РНК-содержащих онкогенных вирусов саркомы Рауса, птичьего миелобластоза, лейкемии Раушера, в ряде опухолей человека. До ее открытия полагали, что генетическая информация передается только с ДНК на РНК (транскрипция). Этот фермент синтезирует ДНК на РНК, переносит генетическую информацию с РНК на ДНК, в связи с чем получил название обратной транскриптазы или ревертазы, Ревертаза обладает тремя ферментативными активностями.
Первая из них — РНК-зависимая ДНК-полимеразная. Она обеспечивает синтез одноцепочечной комплементарной ДНК (кДНК) по матрице РНК; требует затравки, которой может служить гомо- или гетерополимер длиной от 4 до 200 нуклеотидов, построенный либо из рибо-, либо из дезоксирибонуклеотидов, т. е. обязательно содержащий З'-ОН-группу.
Вторая активность — ДНК-зависимая ДНК-полимеразная, обеспечивающая синтез второй цепи ДНК (анти- кДНК) и отвечающая за превращение одноцепочечной ДНК в двухцепочечную форму на матрице ДНК. Третья — активность РНКазы Н, гидролизирующей РНК в составе РНК-ДНК-гибрида. Сначала обратная транскриптаза синтезирует на матрице РНК комплементарную цепь ДНК, в результате чего образуется двухцепочечная гибридная молекула РНК-ДНК. Исходная молекула РНК разрушается. На оставшейся цепи ДНК обратная транскриптаза достраивает вторую цепь ДНК, получается двухцепочечная молекула.
|
|
|
Образовавшаяся таким образом двухцепочечная вирусная ДНК может встраиваться в геном (хромосому) клетки хозяина. В дальнейшем это приводит либо к размножению онкорнавируса (РНК-овый онкогенный вирус), либо к образованию опухоли. Ген, кодирующий синтез обратной транскриптазы, содержится в геноме онкорнавируса.
Изучение свойств обратной транскриптазы показало, что она не обладает избирательностью в отношении матрицы и затравки. Это позволило использовать фермент в генетической инженерии для синтеза генов, для изучения разных участков вирусных геномов, а также числа генов в эукариотических клетках, их первичной структуры, процессинга РНК.
ДНК-лигазы. Единичные разрывы в цепи ДНК устраняются ферментами RHK-лигазами. Они катализируют образование фосфодиэфирной связи между З'-ОН и 5'-фосфорилом, между фрагментами ДНК, сближенными на расстояние одного нуклеотидного звена. Синтез происходит сопряженно с расщеплением пирофосфатной связи в НАД+ (Е. coli и другие прокариоты) или Атф (эукариоты). Так образуются ковалентно замкнутые нити ДНК.
При этом от НАД+ отщепляется НМН (никотинамидмононуклеотид), а от АТФ — Н4Р207. Образующийся в обоих случаях АМФ присоединяется сначала к ферменту, а затем к сшиваемому 5'-концу ДНК, активируя его и выделяясь после завершения лигазной реакции. Лигазы играют важную роль в метаболизме нуклеиновых кислот, участвуют в процессах репликации, репарации и рекомбинации. В генетической инженерии лигазы используют для «сшивания» молекул ДНК.
Репликаза. Репликацию РНК РНК-содержащих вирусов проводит РНК-зависимая РНК-полимераза (РНК-репликаза). Образование этого фермента в зараженной вирусом клетке индуцирует вирусная РНК. Репликаза использует нуклеозидтрифосфаты для синтеза одноцепочечной вирусной РНК. На первой стадии синтеза фермент образует на матрице РНК вируса комплементарную РНК с противоположной полярностью (репликативная форма). На второй стадии эта цепь служит матрицей для синтеза множества новых вирусных цепей РНК. Обе стадии синтеза катализируются одним и тем же ферментом, но в каждой из них участвуют различные белковые факторы.
Полинуклеотидфосфорилаза. Полинуклеотидфосфорилаза катализирует синтез РНК из рибонуклеозиддифосфатов: PHKn+ НДФ⇆РНКn+1 + Фn. Для синтеза требуется затравочная цепь РНК со свободной 3'-ОН-группой, к которой присоединяются мононуклеотиды. Состав продукта полностью определяется соотношением рибонуклеозиддифосфатов в исходной смеси, что позволяет получить in vitro полимеры с заданным нуклеотидным составом. В связи с этим полинуклеотидфосфорилаза была использована для построения матриц с целью расшифровки генетического кода. Поскольку реакция, катализируемая полинуклеотид-фосфорилазой, обратима, считают, что в клетке с ее помощью происходит разрушение короткоживущих мРНК.
|
|
|
ДНК-(цитозин-5)-метилтрансферазы (ДНК-метилазы). Известно, что в ДНК наряду с основными азотистыми основаниями содержатся минорные компоненты — метилированные, глюкозилированные и иным образом модифицированные основания. Они наряду с особенностями первичной структуры обеспечивают видовую специфичность ДНК. Модификация обычных азотистых оснований протекает после того, как цепи ДНК уже построены. Например, метилируются 6-аминогруппа аденина и С-5 цитозина. Метильная группа с S-аденозилметионина переносится на адениновый или ци-тозиновый остаток в цепи ДНК. Процесс катализирует фермент ДНК-метилаза. Метилирование происходит в строго определенных точках молекулы ДНК, где находятся специфические последовательности нуклеотидов. Метилирование защищает ДНК от расщепляющего действия ДНК-рестрикционных ферментов.
Нуклеазы. Ферменты, расщепляющие фосфодиэфирные связи в молекулах нуклеиновых кислот, называются нуклеазами. Расщепление фосфодиэфирной связи может осуществляться двумя способами: в одном случае образуются продукты, фосфорилированные на 5'-конце, в другом — на 3'-конце. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы гидролизуют фосфодиэфирные связи внутри молекулы одновременно во многих точках с образованием обломков различной величины. Экзонуклеазы отделяют один нуклеотид за другим от одного из концов полинуклеотидной цепи. В зависимости от специфичности к субстрату нуклеазы делят на две группы: рибонуклеазы (РНКазы) и дезоксирибонуклеазы (ДНК-азы).
Функции РНКаз в клетке разнообразны. Например, РНКаза I расщепляет РНК разных типов до мононуклеотидов, которые используются впоследствии для синтеза новых РНК. РНКазы II, III, IV, Р участвуют в процессинге мРНК, рРНК, тРНК, которые образуются сначала в виде молекул-предшественников. РНКаза специфически расщепляет РНК в ДНК-РНК гибридных комплексах. Она может участвовать в расщеплении РНК-затравок при синтезе ДНК, а также в расщеплении РНК при работе обратной транскриптазы.
С помощью рестриктаз бактерии могут разрушать чужеродные ДНК, попавшие в клетку в результате конъюгации или вирусной инфекции. Таким образом, рестриктазы защищают бактериальную клетку от внедрившейся в нее чужеродной ДНК. Чтобы остаться в клетке нерасщепленной, чужеродная ДНК должна быть определенным образом метилированной.
Рестриктазы обладают специфичностью к:
1) узнаваемой последовательности,
2) месту рестрикции (расщепление),
3) метилированию оснований узнаваемой последовательности.
Название рестриктаз трехбуквенное, его образуют первая буква названия рода микроорганизма-продуцента и первые две буквы названия вида. Если рестриктаза кодируется геном плазмиды или фага, то указывают символ этого нехромосомного элемента, например EcoR. Если штамм содержит несколько рестриктаз, то они обозначаются римскими цифрами: Hind I, Hind II, Hind III. Если несколько штаммов бактерий одного вида содержат разные рестриктазы, то к трем буквам названия добавляют цифровое или буквенное обозначение штамма: Есо В, Есо К.
Рестриктазы II типа состоят из двух отдельных белков — собственно рестриктазы и метилазы. Эти ферменты «узнают» определенную последовательность в ДНК, которая обычно представляет собой палиндром из 4 или 6 пар нуклеотидов. Рестриктаза, имеющая небольшую молекулярную массу (около 60 000), «разрезает» либо эту последовательность, либо последовательность, расположенную рядом. Например, EcoR 1 -эндонуклеаза узнает гексануклеотидную последовательность и разрезает ее в точках, указанных стрелками (звездочками указаны места метилирования);
↓
5'—Г—А*─ А—Т—Т─Ц-3'
3'—Ц─Т—Т─А—А*─Г—5'
↑
Участки расщепления представляют собой палиндромы. EcoR I -эндонуклеаза расщепляет две цепи ДНК в разных точках; поэтому продукты расщепления имеют «липкие» концы.
Эндонуклеаза Hind II (рестриктаза бактерии Hemophilus influenzae) расщепляет ДНК, образуя «тупые» концы, в следующих участках:
↓
5'—Г—Т—Пир—Пур-А—Ц—3
3'—Ц—А—Пур—Пир—Т—Г—5'
↑
Метилазы модифицируют основания ДНК в этих же специфических участках.
Наиболее отчетливая разница между ферментами I и III типов, с одной стороны, и II типа, с другой, проявляется в природе продуктов расщепления. В результате действия на ДНК рестриктаз типа I образуются гетерогенные продукты, а типа III — продукты неполного расщепления субстрата. Только рестриктазы II типа специфично и полно расщепляют ДНК на фрагменты, соответствующие по длине расстояниям между узнаваемыми последовательностями. Поэтому именно рестриктазы II типа широко используют в генетической инженерии. Поскольку рестриктазы расщепляют цепи ДНК в участках, имеющих строго специфичную последовательность нуклеотидов, их используют в экспериментах по определению первичной структуры ДНК.
Топоизомеразы. ДНК-топоизомеразы — это ферменты, изменяющие число супервитков в кольцевой замкнутой ДНК. Известны топоизомеразы, воздействующие на одноцепочечные и на двухцепочечные молекулы ДНК. Среди них обнаружены ферменты, которые объединяют две или более молекул ДНК в катенаны (зацепленные кольца). Топоизомераза I разрывает одну из цепей кольцевой суперспирализованной ДНК, тогда цепи раскручиваются, уменьшается число супервитков, затем этот же фермент устраняет разрыв.
К этому же классу ферментов относится фермент гираза (топоизомераза II). Гираза превращает расслабленную несверхспирализованную замкнутую кольцевую ДНК в суперспираль, т. е. проявляет действие, противоположное топоизомеразе I. На эту реакцию затрачивается большое количество АТФ. Если вывести из строя гиразу, то в клетке нарушаются самые важные процессы, в частности репликация ДНК.
Синтез ДНК
Полуконсервативная репликация ДНК. Д. Уотсон и Ф. Крик предложили гипотезу механизма синтеза ДНК путем удвоения (репликации). Согласно этому механизму двухцепочечная молекула ДНК сначала разделяется вдоль, две ее цепи расходятся. На каждой старой цепи образуется новая цепь. При этом нуклеотиды новых цепей спариваются комплементарно с нуклеотидами старых цепей, так что старые цепи служат матрицами. Так образуются две дочерние двухцепочечные молекулы ДНК, совершенно одинаковые, идентичные родительской молекуле. В каждой дочерней молекуле одна цепь получена от родительской ДНК, а вторая синтезирована заново. Этот путь синтеза получил название полуконсервативной репликации.
Однако теоретически возможны еще два механизма разделения ДНК между дочерними клетками поровну, получившие название консервативной и дисперсной репликации. При консервативной репликации на двух цепях родительской молекулы ДНК, без их разделения, синтезируется новая молекула ДНК. Дисперсный механизм предполагает дробление молекул ДНК, в результате которого каждая отдельная цепь новых дочерних молекул содержит в себе участки как старой, так и новой цепи ДНК (рис.9).

Рис. 9. Возможные способы воспроизведения ДНК: / — консервативный, // — полуконсервативный, /// — дисперсный
М. Месельсон и Ф. Сталь (1958) в опытах с Е. coli доказали, что в клетке репликация ДНК происходит полуконсервативным способом. Они выращивали Е. coli на синтетической среде, содержащей глюкозу и соли. Источник азота NH4C1 вместо обычного легкого азота 14N содержал тяжелый 15N, так что все азотсодержащие вещества бактерий, в том числе и ДНК, становились «тяжелыми». Затем бактериальные клетки отмывали и переносили на «легкую» питательную среду, содержащую изотоп азота 14N, где происходил их дальнейший рост. Через различные промежутки времени из бактерий выделяли ДНК и центрифугировали ее в градиенте плотности CsCl. Для нулевого поколения была получена единственная полоса,соответствующая 15N-ДНК. После кратковременного роста, в течение которого число клеток удваивалось, в градиенте появилась другая, более легкая полоса. Плотность ее соответствовала гибридной молекуле ДНК, которая содержит равное количество 15N и 14N. По-видимому, цепи с 14N были вновь синтезированными. Это именно тот результат, которого следовало ожидать, исходя из полуконсервативного механизма. После репликации ДНК, завершения двух циклов деления бактерий, в градиенте плотности обнаруживали две полосы ДНК разной плотности. Одна из этих полос соответствовала гибридной ДНК, содержащей 15N и 14N, вторая — ДНК, содержащей обе цепи с 14N. Эти данные убедительно доказывают, что синтез ДНК происходит полуконсервативным способом.
Репликация ДНК как многоступенчатый процесс. Для того чтобы ДНК могла реплицироваться полуконсервативным способом, она должна разделиться на составляющие ее цепи. Установлено, что цепи ДНК раскручиваются не по всей длине, а на коротком участке. Здесь образуется вилка репликации — место удвоения ДНК. Перемещение репликационной вилки возможно только при раскручивании двухспиральной ДНК (хеликса) и закручивании двух дочерних молекул. Конформацию хеликса изменяет ряд ферментов; их делят на три группы.
Первую группу составляют хеликазы — белки, расплетающие двойную спираль и удерживающие одиночные цепи от воссоединения. К ним у Е. coli относятся связывающий белок и гер-белок.
Вторая группа—свивелазы (топоизомераз I, или релаксирующие белки). С их помощью устраняется суперспирализация ДНК (т. е. они выполняют функцию шарнира). Свивелазы вносят в одну из цепей ДНК разрыв, благодаря чему делается возможным раскручивание этой цепи с последующим замыканием разрыва. Третью группу составляют жиразы (гиразы) — топоизомеразы II. Они вызывают негативную суперспирализацию в кольцевой ДНК путем разрыва одной связи, вращения цепи и замыкания связи. Фактически тоже выполняют функцию шарнира.
Геномы фагов и бактерий реплицируются как единое целое. Они представляют собой организованные единицы репликации, так называемые репликоны. Репликон имеет начало — ori (от англ. origin— начало), ориентированное направление и иногда терминальный участок— ter.
Репликация начинается в участке ori. Здесь цепи ДНК расходятся, образуются две репликационные вилки, в которых синтезируются новые цепи ДНК. Если ДНК имеет кольцевую форму, то репликационные вилки передвигаются навстречу друг другу до тех пор, пока ДНК не будет скопирована полностью (или до точки ter). У некоторых плазмид обнаружена однонаправленная репликация, при которой одна репликационная вилка движется в определенном направлении.
Процесс репликации ДНК делится на три основных этапа: 1) инициация, 2) элонгация, или рост цепи, 3) терминация. Согласно электронно-микроскопическим, радиоавтографическим и генетическим данным, в репликационной вилке с большой скоростью осуществляется синтез двух противоположно ориентированных цепей ДНК. Синтез ДНК проводят ДНК-полимеразы, праймерами для которых in vivo служат фрагменты РНК.
Важную роль в инициации репликации в точке ori играет белок В. После расплетания двойной спирали В-белок связывается в участке ori. с матрицей лидирующей цепи; инициирует ее праймер, затем перемещается в противоположном направлении и обеспечивает инициацию праймеров запаздывающей цепи. Таким образом, B-белок выполняет у Е.coli функции «мобильного промотора», т. е. участка инициации транскрипции.
Механизмы терминации репликации исследованы недостаточно. В ДНК Е. coli для терминации существует специальный участок — терминатор. В геноме ряда бактериофагов терминаторы отсутствуют, двусторонняя репликация завершается, видимо, после встречи двух вилок и реплицирующих комплексов.
Детали репликации хромосом эукариот изучены недостаточно, однако общие черты процесса можно представить следующим образом. Хромосома эукариот — это полирепликонная структура, т. е. в ней есть множество независимых репликонов, каждый из которых содержит начало и терминатор. Смежные репликоны ориентированы противоположно, после завершения репликации их реплики, т. е. синтезированные комплементарные нити, сливаются. Размеры репликонов составляют от 10 до 100 мкм, что отвечает 3 х 104—3 х105 нуклеотидных пар. Высокая скорость репликации обеспечивается образованием большого числа репликационных вилок.
Репликация геномов вирусов и фагов часто осуществляется путем использования ферментов клетки хозяина. Однако она может быть организована иначе, чем у бактерий.
В инфицированных плазмидами бактериях нередко обнаруживаются олигомерные геномы плазмид. Образование таких форм объясняет модель репликации ДНК, получившая название «катящегося кольца». Согласно этой модели, одна цепь двухспиральной кольцевой молекулы ДНК разрывается, и ее 5'-конец прикрепляется к мембране клеточной стенки. Затем происходит полуконсервативная репликация, в ходе которой вторая цепь сохраняет кольцевую форму: она как бы «катится», представляя собой бесконечную матрицу. Если репликация завершится в той же точке, откуда она началась, то будет синтезирован геном-мономер, если же кольцо «покатится» дальше, то появятся олигомеры, содержащие несколько геномов. Такие продукты репликации могут мономеризоваться и приобретать кольцевую форму за счет рекомбинации.
Синтез РНК
Транскрипция. Транскрипция у прокариот. Транскрипция — процесс, посредством которого заключенная в ДНК генетическая информация «переписывается» в одиночные цепи РНК. Впоследствии РНК переносится к рибосомам.
Единицы процесса транскрипции несут информацию о структуре одного или нескольких белков. Участок ДНК, в котором заключена информация о структуре одного белка, называется цистроном или структурным геном. Регуляция транскрипции осуществляется благодаря наличию в ДНК специальных регуляторных участков. Регуляторная зона включает в себя промотор, оператор, а нередко и другие участки управления.
ДНК-зависимый синтез РНК можно разбить на несколько стадий, которые в целом составляют цикл транскрипции. Они подробно изучены на прокариотических объектах. Первая стадия транскрипции — инициация — включает взаимодействие РНК-полимеразы с матричной ДНК. РНК-полимераза может связываться с любым участком ДНК, при этом образуется неспецифический слабый комплекс с коротким периодом полураспада. Через серию актов ассоциации — диссоциации на случайных последовательностях ДНК РНК-полимераза находит промотор. В области промотора образуется сначала закрытый стабильный комплекс ДНК и РНК-полимеразы. Затем происходит локальная денатурация ДНК. РНК-полимераза получает прямой доступ к основаниям ДНК, образуется открытый комплекс.
Если имеются соответствующие рибонуклеозидтрифосфаты, то начинается синтез РНК. Первыми нуклеотидами при инициации транскрипции почти всегда бывают А или Г. Образуется трехкомпонентный комплекс ДНК-РНК-полимераза-растущая цепь РНК. Промотор не транскрибируется. Оператор в некоторых случаях частично транскрибируется.
Элонгация (рост цепи) РНК происходит в направлении 5'→3'. Рибонуклеотиды присоединяются к З'-ОН-концу последовательно, один за другим, соответственно матрице ДНК. Скорость процесса элонгации в клетках Е. coli in vivo составляет 45—50 нуклеотидов при 37°С в 1 с.
Терминацию синтеза РНК вызывает последовательность нуклеотидов в ДНК — терминатор или стоп-сигнал. Структура терминаторов полностью не выяснена. Известно, что в их состав входят длинные блоки обнаружены стоп-сигналы другого типа, которые действуют только в присутствии белка, называемогор-фактором. Этот белок с М = 50 000, обычно не связанный с РНК-полимеразой. При его участии цепь РНК освобождается от матрицы ДНК, но фермент еще остается связанным с ДНК. Для высвобождения фермента нужны некоторые дополнительные факторы. Выделен еще один белок, участвующий в терминации,— каппа-частица.
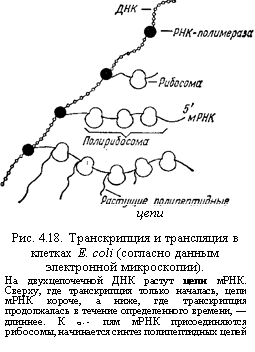
В клетках бактерий к готовому, начинающему отделяться от матрицы участку мРНК присоединяются рибосомы. Они способствуют отделению мРНК от матрицы и начинают синтез белка. Так образуется единый транскрипционно - трансляционный комплекс, который удалось обнаружить методом электронной микроскопии (рис. 10).
Рис. 10. Транскрипция и трансляция в клетках E.coli
ферментные системы, считывающие информацию с генома про- и эукариот, и этапы превращений первичных продуктов транскрипции в зрелые молекулы мРНК.
Процессинг мРНК. В эукариотических клетках первичные транскрипты превращаются в мРНК в ходе процессинга. Пре-мРНК составляют основную фракцию гетерогенной ядерной РНК (гяРНК), которую выделили впервые в 1961 г. Г. П. Георгиев и сотрудники. Пре-мРНК содержит от 5 000 до 50 000 нуклеотидов, в то время как мРНК относительно коротки, их средний размер составляет около 2000 нуклеотидов. Одна мРНК кодирует одну полипептидную цепь, т. е. является моноцистронной. Каждая молекула пре-мРНК обычно дает начало только одной молекуле мРНК, при этом большая часть цепи пре-мРНК (иногда до 90% и более), соответствующая некодирующей зоне ДНК, подвергается ферментативному расщеплению до свободных нуклеотидов и в цитоплазму не поступает. Эти изменения представляют собой часть процессинга.
Процессинг (посттранскрипционная модификация) включает в себя:
1) отрезание «лишних» концевых последовательностей,
2) расщепление длинных первичных транскриптов, «вырезание» из них участков, транскрибированных с интронов,
3) добавление нук-леотидов к 3'-концу транскрипта,
4) добавление нуклеотидов к 5'-концу в транскриптал
5) модификацию оснований в транскрипте.
Процессинг протекает в ядре. К 3'-концу пре-мРНК присоединяется (с участием специального фермента) последовательность из 150—200 адениловых нуклеотидов — поли (А)-фрагмент, к 5'-концу присоединяется кэп. Вырезание интронов из первичного транскрипта сопровождается сплайсингом. Механизм сплайсинга точно не выяснен. Предполагают, что в нем участвуют особая UI -РНК и некоторый фермент. UI -РНК узнает места соединения интронов и экзонов, она взаимодействует с ними по принципу комплементарности, образуя гибрид пре-мРНК — комплекс UI -РНК-фермент.
Это приводит к сближению двух участков пре-мРНК, транскрибированных с соседних экзонов. Участок, транскрибированный с нитрона, образует петлю. Образовавшиеся гибриды могут быть местами атак РНКаз, специфичных для двухнитевых участков РНК. После вырезания «лишнего» участка, т. е. транскрибированного с интрона, специальные лигазы сшивают два конца разрезанной молекулы пре-мРНК.
В результате процессинга из пре-мРНК получается молекула мРНК, имеющая 5'~кэп-, универсальный 3'-поли (А) блок и одну кодирующую последовательность. Для прокариотичеоких клеток процессинг не характерен. Сплайсинг протекает в эукариотических клетках при биосинтезе как мРНК, так и тРНК, рРНК. Например, сплайсингу подвергаются некоторые тРНК дрожжей, хотя их интроны очень малы по размерам. У дрозофилы гены рРНК также содержат интрон.
Рибонуклеопротеиновые комплексы (РНП-комплекеы). Молекулы РНК сразу же после транскрипции соединяются с белками, образуя компактные структуры. РНП-комплексы, содержащие гяРНК, называются ядерными информосомами (гяРНП). Отношение белок: РНК составляет в них 4:1.
Кроме гяРНК в составе гяРНП обнаружены низкомолекулярные стабильные РНК, имеющие коэффициенты седиментации от 4,5 S до 6,5 S. Они тесно связаны как с самими молекулами гяРНК, так и с белками РНП-частиц.
Общую схему строения гяРНП можно представить следующим образом. Вдоль цепи гяРНК формируются многочисленные моночастицы, расположенные нестрого регулярно. Эти 30—40S частицы состоят из белковой глобулы (информофера), на поверхности которой некоторым образом «накручен» небольшой (600 нуклеотидов) участок цепи гяРНК. Моночастицы чередуются с гетерогенными (30—200S) РНП-комплексами. Такие структуры обнаруживаются при электронной микроскопии в виде отходящих от хроматина фибрилл со множеством повторяющихся РНП-частиц.
Предполагают, что определенные третичная и четвертичная структуры гяРНК, обусловленные взаимодействием с белками, способствуют точному протеканию процессинга и сплайсинга. Установлено, что процессинг гяРНК протекает в составе РНП-частиц. В цитоплазме мРНП появляются после процессинга гяРНП. Здесь обнаруживаются свободные мРНП-частицы (цитоплазматические информосомы), или мРНП, связанные с полисомами (поли-сомные информосомы). В них отношение белка и РНК по массе составляет 3: 1—4: 1. В состав мРНП-частиц входят молекулы мРНК разных размеров. Связанные с полисомами мРНК активно транслируются. В полисомных и свободных цитоплазматических информосомах содержится не более 15—20 различных белков.
В полисомных информосомах обнаруживаются два основных белка. В свободных информосомах содержится больше белков, среди них — ингибирующие трансляцию белки. Белки мРНП существенно отличаются от белков гяРНП. Переход из ядра в цитоплазму сопровождается сменой белкового компонента РНП-частиц. Белки, связывающиеся с информосомами, маскируют мРНК и обеспечивают ее хранение в цитоплазме в нетранслируемом состоянии. Переход мРНП из информосом в полисомы должен сопровождаться изменением в составе белков: отщеплением или модификацией репрессорных и связыванием активаторных белков (факторы инициации и др.).
Таким образом, в эукариотических клетках мРНК всегда находится в комплексе с белками. РНП-комплекс — это единственная форма существования мРНК в животной и растительной клетке, от момента синтеза пре-мРНК в ядре до распада мРНК в цитоплазме.
Синтез рибосомных и транспортных РНК. Все рибосомные и транспортные РНК синтезируются на матрице ДНК. У Е. coli рибосомные РНК образуются в виде большого предшественника 30 S. Он дает начало всем рРНК—16S, 23S, 5S. При созревании рРНК интенсивно метилируются. Транспортные РНК у прокариот также транскрибируются в виде предшественников, содержащих одну или более тРНК. Например, гены фага Т4 кодируют предшественник сразу двух тРНК — пролиновой и сериновой. Он «нарезается» на мономеры, от которых отщепляются «лишние» участки. Если у продуктов расщепления отсутствует ЦЦА-последовательность, то она достраивается специальным ферментом.
В эукариотических клетках рРНК кодируются областью хромосомы, которая образует ядрышко — ядрышковый организатор. Здесь несколько сотен раз повторяется участок, который кодирует 28 S, 18 S, 5,8 S рРНК. На транскрибируемой области РНК-полимераза / образует крупный предшественник. От него чрезвычайно быстро удаляется несколько сотен нуклеотидов, находящихся на 5'-конце. Оставшийся предшественник подвергается процессингу. В клетках млекопитающих обнаружено 8 различных по размеру пре-рРНК (от 45 S до 12 S), поэтому предполагают, что существуют, по крайней мере три пути процессинга. Места разрывов предшественника (45 S РНК) одинаковы во всех случаях, мест разрывов всего пять, но порядок расщепления может отличаться. Обычно 45 S расщепляется на две части эндонуклеазой. Затем другие ферменты удаляют спейсеры (разделяющие последовательности). Из одной половины образуется 18 S рРНК, из другой — 28 S и 5,8 S рРНК, связанные водородными связями.
4.9. Генетическая инженерия. Давней мечтой генетиков и биохимиков было получение живых организмов с заранее известными наследственными свойствами, с определенным обменом веществ. Эту задачу ставит перед собой новое направление в науке — генетическая инженерия. Ее основная цель — получение рекомбинантных молекул ДНК in vitro, их размножение и введение в организм с целью получения новых наследственных свойств. В основе генетической инженерии лежит универсальность свойств генетического материала, что позволяет создавать рекомбинантные молекулы ДНК из молекул ДНК разных организмов, например из клеток бактерий и клеток эукариот, и вводить такие рекомбинантные молекулы в живые клетки. Генная инженерия открывает путь для создания в короткие сроки высокопродуктивных промышленных штаммов бактерий, повышения урожайности растений и лечения генетических заболеваний человека. На ее основе разработан ряд проектов, имеющих практическое значение, например включение в клетки сельскохозяйственных растений генов, ответственных за фиксацию атмосферного азота. Другой проект — введение нормальных генов в клетки людей, страдающих наследственными заболеваниями.
В настоящее время методы генетической инженерии успешно применяют для создания бактериальных штаммов — продуцентов биологически активных соединений, в том числе гормонов (инсулина, соматостатина), противовирусного препарата интерферона.
Для проведения работ по генетической инженерии требуется прежде всего получение определенных фрагментов ДНК, т. е. генов. С этой целью используют ряд методов. Первые гены были синтезированы химическим путем. В 1969 г. группа X. Кораны синтезировала ген аланиновой тРНК дрожжей, в котором была к то
|
|
|


