 |
Строение, классификация, роль в живой природе
|
|
|
|
Углеводами называют альдегиды и кетоны многоатомных спиртов и полимеры этих соединений. Появление термина «углеводы» связано с тем, что первые исследованные представители этого класса оказались как бы соединением углерода с водой и имели формулу Сn(Н20)n. По мере открытия новых углеводов обнаружили, что не все они удовлетворяют этой формуле: в состав некоторых из них С, Н и О входят в иных соотношениях, а иногда присутствуют N, S, Р. В то же время некоторые представители других классов обладают такой же формулой, например уксусная кислота С2Н4О2.
В биосфере углеводов больше, чем всех других органических соединений, вместе взятых. В растительном мире на их долю приходится 80—90% из расчета на сухое вещество. В животном организме углеводов содержится около 2% массы тела, но значение их одинаково велико для всех живых организмов, о чем свидетельствуют те важные функции, которые они выполняют. Углеводы являются теми продуктами, которые образуются первично в зеленом растении из С02 и Н20 за счет энергии солнечного света и дают начало другим органическим веществам живых организмов. Функции углеводов разнообразны и важны.
Энергетическая. Окисляясь в процессе дыхания, углеводы выделяют заключенную в них энергию и обеспечивают значительную часть потребности организма в ней. При окислении 1 г углеводов выделяется 16,9 кДж энергии.
Пластическая. Углеводы используются на синтез многих важных для организма веществ: нуклеиновых кислот, органических кислот, а из них — аминокислот и далее белков, липидов и т. д.
Защитная. Углеводы — основные компоненты оболочек растительных тканей, они участвуют в построении наружного скелета насекомых и ракообразных, в образовании клеточных стенок бактерий и клеточных мембран всех живых организмов. Опорная. Целлюлоза и другие полисахариды оболочек растительных клеток не только защищают клетки от внешних воздействий, но и образуют прочный остов растения, его механические, опорные ткани. В комплексе с белками углеводы входят в состав хрящевых тканей (хондроитинсульфаты) и других соединительнотканных образований, выполняющих опорные функции у человека и животных.
|
|
|
Регуляторная. Клетчатка, вызывая механическое раздражение кишечника, способствует его перистальтике (движение) и тем самым улучшает пищеварение. Взаимопревращения крахмала и сахаров в замыкающих клетках устьиц растений регулируют движение последних, т. е. замыкание и раскрытие устьиц. Моносахариды играют существенную роль в регуляции осмотических процессов.
Интересны специфические функции углеводов. Углеводсодержащие соединения служат маркерами в процессах узнавания молекулами и клетками друг друга, определяют антигенную специфичность, обусловливают различия групп крови. Некоторые углеводсодержащие биополимеры являются рецепторами для связывания различных токсинов, бактериальных клеток, вирусов, гормонов. Изучены рецепторные функции углеводсодержащих соединений в нервной ткани. В мембранах нервных окончаний обнаружено сравнительно высокое содержание гликопротеинов, которые участвуют в проведении нервного импульса и служат рецепторами для некоторых фармакологически активных соединений.
Углеводы выполняют также функцию запасных питательных веществ. Они способны откладываться в организме в виде гликогена (у человека и животных), крахмала и фруктозанов— (у растений), которые расходуются по мере надобности. Так, в печени регулярно питающегося животного может накапливаться гликоген до 10% от массы ткани; содержание его при голодании снижается до 0,2%.
|
|
|
Углеводы обычно подразделяют на моносахариды, олигосахариды и полисахариды (гликаны).
К моносахаридам относятся углеводы и их производные, которые не способны расщепляться без потери основных углеводных свойств.
Олигосахариды (полисахариды I порядка) гидролизуются с образованием небольшого числа моносахаридов (от 2 до 10).
Полисахариды I порядка (гликаны) представляют собой высокомолекулярные полимеры моносахаридов и их производных с различным составом и строением. Число остатков моносахаридных единиц в них от 10 до нескольких тысяч.
Моносахариды
Классификация и номенклатура, строение молекулы. Существует несколько принципов классификации моносахаридов: моносахариды делят на альдозы и кетозы в зависимости от наличия в них альдегидной или кетонной группы; возможно деление по числу углеродных атомов, входящих в состав молекулы (триозы, тетрозы, пентозы, гексозы, гептозы, октозы и т. д.).
Моносахариды, содержащие более семи углеродных атомов, называют высшими сахарами. По химической природе все моносахариды делят на нейтральные (содержат только карбонильные и спиртовые группы); кислые (содержат еще и карбоксильные группы) и аминосахара, в которых кроме карбонильных и спиртовых групп есть еще и аминогруппа, обусловливающая основные свойства этих соединений. Известны также полифункциональные сахара, содержащие в своем составе помимо карбонильных и гидроксильных групп одновременно и карбоксильную и аминогруппы.
В основу наименований моносахаридов в большинстве случаев используются названия нейтральных сахаров (ксилоза, рибоза, глюкоза, фруктоза). От них производятся наименования аминосахаров (глюкозамин, галактозамин) и карбоксилсодержащих сахаров (глюкуроновая кислота, манноновая кислота, галактаровая кислота). Тривиальные названия моносахаридов обычно складываются из двух частей: корень указывает на какое-либо свойство данного сахара или его происхождение, а окончание -оза — на его принадлежность к углеводам. Например, название «фруктоза» указывает на содержание этого моносахарида во фруктах.
Наименованиям кетоз придается окончание -улоза, например, кетоза С4 — тетрулоза, кетоза С5 — пентулоза. Часто в названиях моносахаридов сочетаются два принципа — указывается как наличие альдегидной или кетонной группировки, так и число атомов углерода: альдопентоза, кетогексоза. Для обозначения разнообразных производных моносахаридов нумеруют атомы углерода, начиная от альдегидной группы или с того конца, к которому ближе кетогруппа, и положение заместителей указывают цифрой, а также тот атом, с которым связан заместитель, если он не связан непосредственно с углеродом. Например: 2-дезокси-2-амино-3,4-ди-0-метилглюкоза.
|
|
|
О
//
(1)С
│ \Н
Н─(2)С─NH2
│
Н3С─О─(3)С─Н
│
Н─(4)С─О─СН3
│
Н─(5)С─ОН
│
(6)СН2ОН
Всем моносахаридам, начиная с триоз, свойственна стереоизомерия, они существуют в двух энантиомерных формах: D и L. Принадлежность моносахарида к D- или L-ряду определяется по расположению ОН-группы у последнего (считая от альдегидной или кето-группы) хирального, относят как к энантиомерам (две зеркально отраженные молекулы, которые не накладываются друг на друга) атома углерода. Если она расположена справа от углеродной цепи, то молекулу относят к D-ряду, если слева — к L-ряду. Обозначения D и L не служат указанием на направление вращения плоскости поляризации. Некоторые моносахариды, отнесенные к D-ряду, являются левовращающими, а многие представители L-ряда — правовращающими. Чтобы указать и принадлежность моносахарида к D- или L-ряду и направление вращения плоскости поляризации, после символов D или L перед названием сахара в скобках ставят знак (+) или (—), обозначающий правое или левое вращение.
В настоящее время твердо установлено, что в природе только небольшая часть молекул пентоз и гексоз содержит открытую цепь, большинство молекул находится в виде циклических структур. Образование последних становится понятным, если вспомнить, что четыре ковалентные связи углерода образуют тетраэдр, поэтому углеродная цепь не представляет собой прямую, а существенно изогнута, что способствует взаимодействию между карбонильной и гидроксильной группами с образованием цикла. Такая реакция характерна для всех моносахаридов с числом углеродных атомов больше четырех. При замыкании молекулы моносахарида в цикл происходит внутримолекулярная реакция образования полуацеталя или полукеталя.
|
|
|
О Н
// /
R—С + НО—СН2—R1→ R—С—ОН
\ \\
Н О─СН2─R1
Альдегид Спирт Полуацеталь
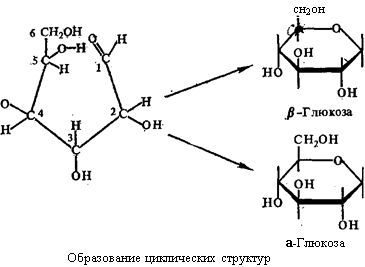
В зависимости от того, гидроксильная группа какого из углеродных атомов принимает участие в образовании полуацеталя или полукеталя, могут получаться пятичленные циклы (из четырех атомов С и одного атома О) или шестичленные (из пяти атомов С и одного атома О). Эти структуры называются, соответственно, фуранозными или пиранозными, по аналогии с известными органическими соединениями — фураном или пираном.
Для моносахаридов ряда пентоз обычно характерен фуранозный цикл, в то время как большинство гексоз находится в пиранозной форме. Образование семичленных колец у гексоз наблюдается редко из-за значительного напряжения связей в таком цикле.
У кетогексоз в образовании полукеталя принимает участие карбонильная группа и гидроксил у C-5 или С-6 в результате чего также образуется фуранозная или пиранозная формы сахара. Пиранозные формы гексоз и пентоз значительно более устойчивы, чем фуранозные, поэтому в растворе всегда существенно преобладают первые. Однако в составе олиго- и полисахаридов гексозы могут присутствовать и в фуранозиой форме (например, фруктофураноза в молекуле сахарозы). Естественная тенденция гексоз и пентоз к циклизации обеспечивает образование устойчивых полимеров из чрезвычайно реакционноспособных неустойчивых мономеров.

Образование моносахаридами циклических форм объясняет «аномалии» в их поведении как альдегидов или кетонов.
Рис. 13. Взаимопревращения различных форм глюкозы в водном растворе.
1. В циклической форме у сахаров нет свободной карбонильной группы, поэтому они не дают некоторые цветные реакции на альдегиды.
2. Полуацетальный и полукетальный гидроксилы в отличие от других гидроксилов в молекуле сахара образуют со спиртами легко гидролизуемые простые эфиры.
3. D- и L-Формы каждого моносахарида существуют в виде α- и β-изомеров, поэтому образуется не 2, а 4 ряда производных.
4. α- и β - Формы моносахаридов, обладающие разной величиной оптического вращения, в процессе растворения в воде взаимно переходят друг в друга, поэтому удельное вращение меняется до установления равновесия.
Физические и химические свойства. Моносахариды — твердые, бесцветные, кристаллические вещества, хорошо растворимые в воде и плохо растворимые (или даже совсем нерастворимые) в органических растворителях (спирт, эфир). Всем им присущ сладкий вкус, но сладость сахаров неодинакова. Если сладкий вкус сахарозы принять за 100%, то у фруктозы он будет равен 173%, глюкозы — 74, ксилозы — 40, лактозы — 16%. Растворы моносахаридов обладают нейтральной реакцией.
|
|
|

-D-Рибоза Фурфурол
СН2ОН
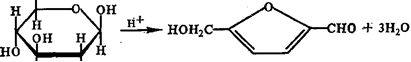
Н ОН
β-D-Глюкоза 5-Оксиметилфурфурол
Действие кислот и оснований на моносахариды. Моносахариды устойчивы в горячих разбавленных растворах неорганических кислот, что позволяет количественно вцделять их в неизмененном виде при гидролизе полисахаридов. Под действием концентрированных кислот моносахариды дегидратируются и дают циклические альдегиды — фурфурали. При этом из гексоз образуется гидроксиметилфурфурол, а из пентоз — фурфурол.
Образующиеся фурфурали могут вступать с фенолами или их производными в реакцию конденсации, давая окрашенные продукты. Это свойство положено в основу некоторых цветных реакций на сахара.
При нагревании с разбавленными щелочами или при высоких их концентрациях свободные моносахариды подвергаются внутримолекулярным перегруппировкам, фрагментации и конденсации. При конденсации сахаров образуются окрашенные продукты (от желтых до темно-коричневых), причем интенсивность окраски зависит от концентрации углевода. Это свойство используют для количественного определения сахаров в моче по Альтгаузену.
Окисление сахаров. При окислении альдоз в кислой среде образуется три класса сахарных кислот: альдоновые, альдаровые и альдуроновые.
В присутствии слабых окислителей (гипоиодит натрия, бромная вода) или под действием специфических ферментов у альдоз окисляется альдегид и образуются альдоновые кислоты (например, из глюкозы — глюконовая, из маннозы — манноновая).
Восстановление моносахаридов. Карбонильная группа моносахарида может быть восстановлена газообразным водородом или амальгамой натрия в воде с образованием соответствующих многоатомных спиртов (иногда называются сахароспиртами). Из D-глюкозы образуется спирт сорбит, а D-манноза дает маннит.
Производные моносахаридов. Гликозиды образуются потипу простых эфиров при взаимодействии полуацетального или полукетального (гликозидного) гидроксила с гидроксильной группой другого соединения. Так, D-глюкоза дает с метанолом метил-α-D-глюкозид и метил-β-D-глюкозид. «Несахарная» часть гликозида называется агликоном.
Своеобразными гликозидами являются также олигосахариды и полисахариды, которые образуются при взаимодействии полуацетальных или полукетальных гидроксилов одних моносахаридов с гидроксилами других моносахаридов. Однако под термином «гликозиды» принято прежде всего понимать соединения сахаров со спиртами-агликонами.
В природе встречается большое разнообразие гликозидов. Многие из них обладают своеобразным (часто горьким) вкусом или специфическим ароматом (синигрин горчицы, глюкованилин), поэтому играют важную роль в пищевой промышленности. Другие находят применение в медицине, например сердечные гликозиды, содержащиеся в растениях родов Strophanthus и Digitalis.
О-Метильные производные. Если ОН-группа при аномерном атоме легко реагирует в кислой среде с метанолом давая метил-гликозиды, то метилирование остальных ОН-групп моносахаридов требует более жестких условий. В этом случае вместо метилацеталей образуются метиловые эфиры, которые в отличие от метилгликозидов не гидролизуются при кипячении с кислотой. Метилирование всех свободных гидроксильных групп углевода называют исчерпывающим метилированием.
Гликозиды метилированных сахаров, благодаря летучести в высоком вакууме, используют для газожидкостной хроматографии и масс-спектрометрии углеводов.
О-Ацильные производные. При замещении атомов водорода гидроксильных групп углеводов остатками кислот получаются вещества типа сложных эфиров.
Аминосахара. Замещение гидроксильной группы при С-2 на аминогруппу приводит к образованию аминосахаров. Широко распространены в природе два аминосахара — D-глюкозамин и D-raлактозамин.
O O
// //
C C
│ \ H │ \H
HCNH2 HCNH2
│ │
HOCH HOCH
│ │
HOCH HOCH
│ │
CH2OH CH2OH
D-Глюкозамин D-Галактозамин
Аминосахара входят в состав многих гликопротеинов и гликолипидов, чаще в форме N-ацетильных производных.
Мурамовая и нейраминовая кислоты. Эти производные сахаров играют ведущую роль в качестве строительных блоков структурных полисахаридов, входящих в состав клеточных стенок бактерий (N-ацетилмурамовая кислота) и плазматических мембран клеток животных (N-ацетилнейраминовая кислота). В молекуле N-ацетилмурамовой кислоты ацетилированный D-глюкозамин связан эфирной связью с молочной кислотой. N-Ацетилнейраминовая кислота содержит остатки ацетилированного D-маннозамина и пировиноградной кислоты. Все О- и N-ацильные производные нейраминовой кислоты имеют общее название — сиаловые кислоты.
Нейраминовая и сиаловая кислоты являются составными компонентами мембран нервной ткани. Однако сиалсодержащие гликолипиды обнаружены и в других тканях. Они выполняют механические, иммунохимические и другие функции, могут восстанавливать электровозбудимость мозговой ткани, специфически связывать или инактивировать некоторые бактериальные токсины.
Отдельные представители моносахаридов. Триозы (С3Н6Оз). Основными представителями являются глицеральдегид и дигидроксиацетон, в свободном виде они обычно не встречаются.
Фосфорные эфиры триоз образуются в организме животных, растений и бактерий как промежуточные продукты превращений более сложных моносахаридов, а также в процессе фотосинтеза у растений и хемосинтеза у бактерий.
Тетрозы (С4Н8О4). Из этой группы моносахаридов заслуживает внимания D-эритроза, которая образуется в качестве промежуточного продукта при фотосинтезе и в пентозофосфатном цикле окисления углеводов в виде 4-фосфорного эфира. Продукт восстановления эритрозы — спирт эритрит — обнаружен у водорослей, лишайников.
Пентозы (С5Н10О5). Представители пентоз в свободном виде встречаются очень редко (в моче, в листьях некоторых растений), чаще они входят в состав более сложных углеводов и других органических соединений; образуются и в качестве промежуточных продуктов в процессе метаболизма углеводов.
L-Арабиноза широко распространена в природе в составе гемицеллюлоз, пектиновых веществ, слизей, гумми. Обнаруживается в свободном виде в моче после употребления больших количеств фруктов или их соков (алиментарная пентозурия). D-Арабиноза входит в состав полисахаридов ряда бактерий, является компонентом некоторых растительных гликозидов.
D-Ксилоза — древесный сахар — обнаруживается у растений в свободной форме, но в значительно большем количестве в составе гемицеллюлоз, растительных слизей. Много ксилозы содержится в соломе, отрубях, древесине, хлопковой шелухе и особенно много (до 12%) в кукурузных кочерыжках, откуда ее и получают для кондитерской промышленности. Образующийся из ксилозы спирт ксилит используют вместо сахарозы в питании больных диабетом и ожирением. У человека, животных и микроорганизмов ксилоза входит в состав гликопротеинов.
D-Рибоза и D-2-дезоксирибоза содержатся в нуклеиновых кислотах и свободных нуклеотидах. Продукт восстановления рибозы — спирт рибитол — составная часть некоторых витаминов, простетических групп ферментов.
В зеленых растениях, в микроорганизмах и тканях животных обнаруженны кетопентозы — D-рибулоза и L-ксилулоза. Фосфорные эфиры этих Сахаров играют важную роль в качестве промежуточных продуктов цикла Кальвина и пентозофосфатного пути окисления углеводов.
Гексозы (С6Н12О6). Многие представители этой группы моносахаридов находятся в природе в свободном виде и играют важную роль в жизни всех организмов.
D-Глюкоза (виноградный сахар, декстроза) присутствует в свободном виде в зеленых частях растений, в семенах, различных фруктах и ягодах, меде, в крови человека и животных. У здорового человека в крови содержится от 0,07 до 0,11% глюкозы. Кроме того, она входит в состав большого числа полисахаридов, многих гликозидов.
D-Фруктоза (плодовый сахар, левулеза). Содержится в свободном виде в зеленых частях растений, в нектаре цветов, плодах, меде.
D-Галактоза входит в состав дисахаридов лактозы и мелибиозы, трисахарида рафинозы, олигосахаридов стахиозы, вербаскозы и целого ряда полисахаридов // порядка как растительного, так и животного происхождения.
D-Манноза встречается в растениях в составе высокомолекулярных полисахаридов — слизей, гемицеллюлоз. В организме животных и человека манноза найдена в гликопротеинах, углеводных цепях протеогликанов. Найдена манноза и у микроорганизмов, в частности в составе некоторых капсулярных полисахаридов и О-антигенных детерминант у грамотрицательных бактерий.
Монодезоксигексозы и их производные известны как структурные компоненты сердечных гликозидов. Ряд 6-дезоксисахаров обнаружен в составе гликолипидов бактерий, а также некоторых антибиотиков. Наиболее широко распространены L-фукоза, L-рамноза и их метильные моно- и диэфиры. Так, L-фукоза является структурным компонентом олигосахаридов молока, специфических полисахаридов групповых веществ крови, бактериальных клеточных стенок.
Дидезоксигексозы и их производные часто встречаются в сердечных гликозидах (например, D-дигитоксоза), Источником 2,6- и 2,4-дидезоксисахаров оказались также некоторые антибиотики. 3,6-Дидезоксисахара были выделены из микробного материала (абеквоза, колитоза и др.); они входят в состав специфических полисахаридов грамотрицательных бактерий и составляют в среднем 10—15% от бактериальных полисахаридов. Значение их велико, поскольку в полисахаридах эти сахара являются терминальными группами, определяющими антигенную специфичность. Известна также 2,3,6-тридезоксигексоза — амицетоза, выделенная из антибиотиков,
Гептозы (С7Н14О7) и другие высшие сахара обнаружены в природе в различных видах. Так, из растений выделены D-седогептулоза, D-манногептулоза и др. Седогептулоза в виде фосфорного эфира образуется в процессе фотосинтеза в качестве промежуточного продукта, а также в пентозофосфатном цикле. Из бактерий изолированы D-глицеро-D-манногептоза, D-глицеро-D-глюкогептоза и другие высшие сахара.
|
|
|


