 |
Р е ш е н и е. Он располагается в четвертом периоде (n = 4, застраивается N-слой), в V(А) группе (имеет 5 валентных электронов …4s24p3, которые располагаются на внешнем слое)
|
|
|
|
Р е ш е н и е
Это элемент As – мышьяк. Его полная электронная формула
33As: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Он располагается в четвертом периоде (n = 4, застраивается N-слой), в V(А) группе (имеет 5 валентных электронов …4s24p3, которые располагаются на внешнем слое). As относится к семейству p-элементов.
Высшая с. о. = +5, так как мышьяк имеет пять валентных электронов. Низшая с. о. = –3, так как до устойчивого электронного октета (4s24p6) ему недостает трех электронов. Примеры: 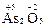 ,
, 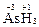 .
.
Пример 8. Почему селен и хром, находясь в одном и том же периоде и в одной группе, обладают столь разными химическими свойствами?
Р е ш е н и е
Селен и хром – это элементы шестого периода VI группы. Селен относится к семейству p-элементов и находится в главной подгруппе, тогда как хром – d-элемент, стоящий в побочной подгруппе.
Атом селена имеет на внешнем слое шесть электронов (…4s24p4), а атом хрома - только один электрон (…. 3d 54s1). Следовательно, у селена сильнее выражены неметаллические свойства, а у хрома – металлические.
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Краткие теоретические сведения
Химическая связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы по сравнению с энергией изолированных атомов. По характеру распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Кроме того, между атомами соседних молекул могут возникать межмолекулярные взаимодействия: водородная связь и (или) вандерваальсовые силы.
|
|
|
Основными характеристиками химической связи являются:
1. Энергия химической связи ЕА – В (кДж/моль) – это мера прочности связи, которая определяется работой, необходимой для разрушения данной связи, или энергией, которая выделяется при образовании связи из отдельных атомов. Чем больше ЕА – В, тем прочнее (устойчивее) частица.
Для молекул типа А2 (например, Н2 или N2) энергия связи равна энергии, которая затрачивается на распад 1 моль молекул типа А2 до атомарного состояния. Для многоатомных молекул типа АВn (например, СН4 или NH3) принято говорить о средней энергии связи 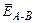 , которая может быть определена по формуле
, которая может быть определена по формуле
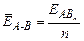 ,
,  (15)
(15)
где 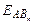 - энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
- энергия образования вещества, кДж/моль; n – число однотипных связей (обычно совпадает с числом атомов В в молекуле).
Для расчета энергии одной связи необходимо 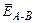 (в кДж/моль) разделить на постоянную Авогадро NА.
(в кДж/моль) разделить на постоянную Авогадро NА.
Разрыв связи в молекуле может быть осуществлен:
1) гомолитически, то есть с образованием атомов АВ ® А + В;
2) гетеролитически, то есть с образованием ионов АВ ® Аz+ + Bz-.
При изменении энергий связей в рядах однотипных соединений можно отметить следующие закономерности:
- чем больше разность между электроотрицательностями (DЭО) элементов, тем больше энергия связи между их атомами (правило Полинга);
- чем больше размеры атомов, тем меньше энергия связи;
- энергия связи в кристалле всегда больше, чем в соответствующей молекуле;
- энергия диссоциации по гомолитическому механизму ниже, чем по гетеролитическому.
2. Длина связи l А – В (нм) – это расстояние между ядрами химически связанных атомов. Эта характеристика зависит от размеров электронных оболочек и степени их перекрывания. Между длиной связи и ее энергией имеется определенная корреляция: чем меньше длина связи, тем больше энергия связи.
3. Угол связи или валентный угол – это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Его определяют с учетом гибридизации центрального атома в молекуле.
|
|
|
Ковалентная связь (КС) – тип связи, который возникает при обобществлении электронов взаимодействующих атомов. Для описания такого вида связи используют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
МВС (иначе метод локализованных электронных пар) основан на следующих положениях:
1. КС образуется двумя атомами за счет перекрывания двух электронных облаков с антипараллельными спинами;
2. Связь располагается в том направлении, в котором будет обеспечиваться наибольшая область перекрывания АО;
3. КС тем прочнее, чем больше область перекрывания АО.
КС может возникнуть:
1) по обменному механизму за счет объединения одноэлектронных АО по одному со стороны каждого атома:
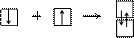 |
Число одноэлектронных АО может увеличиваться при переходе атома в возбужденное состояние;
2) по донорно-акцепторному механизму за счет объединения пары электронов одного атома (донора) и свободной АО другого атома (акцептора):
 |
донор акцептор
Основными свойствами КС являются насыщаемость, направленность и полярность. Общее число КС, которое способен образовать атом, ограничено числом его АО (свободных и занятых), использование которых энергетически выгодно. Для элементов первого и второго периодов энергетически выгодно использование АО только внешнего энергетического уровня. Начиная с третьего и далее периодов, кроме s- и p-орбиталей внешнего уровня в образовании КС могут участвовать d-орбитали внешнего и (или) предвнешнего энергетических уровней. Таким образом, максимальное число КС у каждого атома ограничено его валентными возможностями, то есть связь насыщаема.
Для обеспечения наиболее полного перекрывания электронных облаков взаимодействующие атомы вынуждены располагаться в пространстве относительно друг друга определенным образом – направленно. По типу перекрывания (направленности) различают:
1. s-связь – перекрывание АО происходит вдоль оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению только одной области перекрывания. К образованию такого вида связи способны электронные облака любой формы. Например, sр-р перекрывание образуется таким образом:
|
|
|
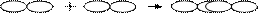
2. p-связь – перекрывание АО происходит по обе стороны от оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению двух областей перекрывания. Например,
p р – р перекрывание:
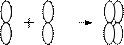
К образованию такого вида связи не способны s-электронные облака;
3. d-связь – перекрывание двух d-орбиталей, находящихся в параллельных плоскостях, с образованием четырех областей перекрывания.
Возникновение p- и d-связей происходит только в том случае, когда взаимодействующие атомы уже связаны s-связью. Наложение p- и d-связей на s-связь приводит к повышению кратности связи (иначе - к повышению порядка связи n), т. е. куменьшению межъядерного расстояния.
Например, в молекуле N2 между атомами азота связь тройная (Nº N): одна s  и две p
и две p  .
.
Направленность КС придает многоатомным частицам определенную форму – конфигурацию, от которой с учетом гибридизации АО зависит внутренняя структура вещества.
Гибридизацией АО называют процесс смешения нескольких различных по форме и энергии АО данного атома, который сопровождается образованием такого же числа новых, одинаковых по форме и энергии гибридных АО, располагающихся в пространстве относительно друг друга таким образом, чтобы обеспечить более полное перекрывание с АО соседних атомов в частице.
В процессе гибридизации могут участвовать как одноэлектронные АО, так и АО, занятые спаренными электронами. Одноэлектронные гибридные АО способны образовывать связи с другими атомами и определяют тем самым геометрическую форму молекулы или иона, поэтому их называют связывающими. Двухэлектронные гибридные АО обычно не участвуют в образовании связей (исключение – донорно-акцепторный механизм), называются несвязывающими (при записи формулы молекулы их обозначают Ё) и не учитываются при выявлении геометрической формы образовавшейся частицы. В табл. 5 приведены наиболее распространенные виды гибридизаций АО и формы молекул, которые им соответствуют.
|
|
|
Таблица 5
|
|
|


