 |
Таблица 6. Строение и ожидаемая полярность молекул
|
|
|
|
Таблица 6
Строение и ожидаемая полярность молекул
| Тип молекулы | Геометрическая форма | Ожидаемая полярность | Примеры |
| АВ | Гантелевидная | Полярная | НCl, ClF |
| АВ2 | Линейная Угловая | Неполярная Полярная | CO2, CS2 H2O, SO2 |
| АВ3 | Треугольная Тригональная пирамида Т-образная | Неполярная Полярная Полярная | BCl3, SO3 NH3, PCl3 ClF3, BrF3 |
| АВ4 | Тетраэдр Квадрат Искаженный тетраэдр | Неполярная Неполярная Полярная | CCl4, SiF4 XeF4 SF4, TeCl4 |
| АВ5 | Тригональная бипирамида Квадратная пирамида | Неполярная Полярная | PF5, PCl5 IF5 |
| АВ6 | Октаэдр | Неполярная | SF6, WF6 |
| АВ7 | Пентагональная бипирамида | Неполярная | IF7 |
Образование молекул по ММО принято представлять в виде энергетических диаграмм (см. примеры решения задач). В средней части диаграммы изображают МО, а по краям располагают АО взаимодействующих атомов в соответствии с их энергиями. Связывающие МО всегда находятся ниже исходных АО, а разрыхляющие МО – выше, поскольку им соответствует более высокая энергия.
По энергетической диаграмме ММО можно определять:
1. Кратность или порядок связи n по формуле
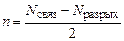 , (18)
, (18)
где 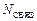 – количество электронов на связывающих МО;
– количество электронов на связывающих МО; 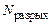 – количество электронов на разрыхляющих МО. С увеличением порядка связи в однотипных молекулах растет энергия связи и уменьшается ее длина;
– количество электронов на разрыхляющих МО. С увеличением порядка связи в однотипных молекулах растет энергия связи и уменьшается ее длина;
2. Магнитные свойства частицы: если на МО имеются непарные электроны, то молекула обладает свойствами парамагнетика (на ее поведение оказывает влияние магнитное поле), а если все электроны спарены, то она диамагнитная (не реагирует на магнитное поле).
При описании по ММО двухатомных гетероядерных молекул, то есть молекул, образованных разными по природе элементами, следует учитывать, что исходные АО одинаковых подуровней у взаимодействующих атомов будут обладать различными значениями энергий. У более электроотрицательного атома (атом В) энергия АО несколько ниже, чем у атома с меньшим значением ЭО (атом А) (см. рис. 3). Поэтому в таких молекулах связывающие МО располагаются ближе к АО атома с большим значением ЭО, а разрыхляющие – ближе к атому с меньшим значением ЭО. Разность между энергиями АО взаимодействующих атомов b характеризует полярность связи, а разность между энергиями АО и ближайшей к атому МО а характеризует ковалентность связи. Чем больше b (меньше а), тем больше полярность связи, т. е. выше ее СИ и меньше СК.
|
|
|
|
|
|
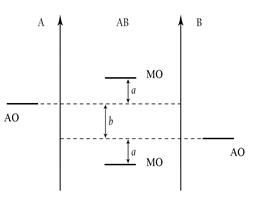
Рис. 3. Энергетическая диаграмма гетероядерной молекулы типа АВ
Чем больше DЭО атомов, образующих химическую связь, тем выше ее СИ, то есть больше эффективный заряд на атомах. При DЭО > 1, 9 величина эффективного заряда q > ½ 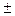 0, 5 е½ (см. рис. 1) и вполне допустимо рассматривать атомы как ионы с целочисленными зарядами. Химическая связь, возникающая между такими частицами, называется ионной.
0, 5 е½ (см. рис. 1) и вполне допустимо рассматривать атомы как ионы с целочисленными зарядами. Химическая связь, возникающая между такими частицами, называется ионной.
Электрическое поле, создаваемое ионами, является сферическим, поэтому каждый ион способен притягивать к себе независимо от направления сразу несколько ионов другого знака, количество которых зависит от размеров и зарядов взаимодействующих частиц. Таким образом, ионная связь, в отличие от КС, не насыщаема и не направлена.
Ионные соединения в твердом состоянии образуют ионные кристаллические решетки, характерными особенностями которых являются высокие значения энергии связи, температуры плавления и твердости. Вещества с ионными или сильно полярными связями (соли, кислоты) способны к диссоциации на ионы в расплавах или растворах полярных растворителей, при этом диссоциация в первую очередь протекает по наиболее полярной связи.
|
|
|
Свойства ионных соединений во многом определяются взаимной поляризацией ионов, которая приводит к уменьшению СИ химической связи.
Поляризацией называют суммарный эффект, получающийся при сочетании поляризующего действия (ПД) ионов с их поляризуемостью. Поляризуемость – это способность электронного облака частицы к деформации под действием электростатического поля другого иона, а напряженность этого поля определяет ПД иона. На практике для определения эффекта поляризации можно принимать во внимание только ПД катиона и поляризуемость аниона.
ПД катиона тем значительнее, чем меньше радиус, больше его заряд и главное квантовое число внешних АО иона. Поэтому наиболее сильным ПД обладают катионы малых периодов. Поляризуемость аниона тем выше, чем больше его радиус, заряд и значение главного квантового числа внешних АО. При одинаковом значении главного квантового числа d-электроны поляризуются в большей степени, чем p- и s-электроны.
Силы электростатического взаимодействия между молекулами, возникающие без передачи атомами электронов на расстояниях, превышающих длину связи, называются вандерваальсовыми силами. Различают три вида такого взаимодействия: ориентационное, индукционное и дисперсионное. Ориентационное взаимодействие проявляется между полярными молекулами, индукционное – при действии полярной молекулы на неполярную, а дисперсионное – является универсальным, так как проявляется в любых случаях.
Наличие вандерваальсовых сил обусловливает притяжение молекул и агрегацию вещества с образованием молекулярных кристаллов. Такие силы гораздо слабее, чем ковалентная или ионная связь, поэтому вещества с молекулярно-кристаллическим строением характеризуются невысокими температурами плавления, способностью к возгонке и малой твердостью.
Промежуточное положение между химической связью и вандерваальсовыми взаимодействиями занимает водородная связь (ВС), которая возникает между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованными атомами F, O или N (реже - Cl или S), принадлежащими другим молекулам. ВС проявляется тем сильнее, чем больше ЭО и меньше радиус атома-партнера.
|
|
|
Возникновение ВС обусловлено способностью атома водорода глубоко внедряться в электронную оболочку атома с высокой ЭО из-за своего малого размера и отсутствия внутренних электронных слоев. Энергия ВС невелика (8–80 кДж/моль), поэтому такую связь легко разрушить.
Наличие ВС является причиной объединения молекул в димеры или более сложные ассоциаты, а также объясняет аномально высокие температуры кипения и плавления некоторых веществ, так как на разрыв таких связей требуется дополнительная затрата энергии.
|
|
|


