 |
Р е ш е н и Е. В любом оксиде С. О. Кислорода равна –2, тогда по формуле (9). Следовательно, . Строение атомов и свойства химических элементов
|
|
|
|
Р е ш е н и е
По закону эквивалентов [из формулы (13)]
.
Молярную эквивалентную массу оксида можно представить так:
МЭ(оксида) = МЭ(Ме) + МЭ(О).
В любом оксиде с. о. кислорода равна –2, тогда по формуле (9)
.
Следовательно,
.
Откуда находим, что МЭ(Ме) = 9 г/моль. Относительную атомную массу металла рассчитываем по формуле
Аr(Ме) = МЭ(Ме) × В = 9 × 3 = 27.
Ответ: МЭ(Ме) = 9 г/моль; Аr(Ме) = 27; металл – алюминий.
Пример 12. Мышьяк образует оксид, содержащий 75, 75 % мас. мышьяка. Вычислите МЭ(As) и установите простейшую формулу оксида.
Р е ш е н и е
Оксид мышьяка состоит из элементов As и О. Тогда закон эквивалентов можно записать так:
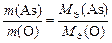 .
.
Отношение масс элементов в оксиде равно отношению массовых долей (% мас. ) этих элементов, а МЭ(О) = 8 г/моль в любом оксиде. Тогда
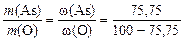
или
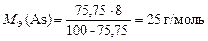 .
.
Для того чтобы записать химическую формулу оксида, вычисляем валентность мышьяка в оксиде по формуле
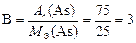 .
.
Ответ:  ; химическая формула оксида As2O3 .
; химическая формула оксида As2O3 .
Пример 13. На восстановление 3, 6 г оксида металла израсходовали 1, 7 дм3 водорода (н. у. ). Чему равна молярная эквивалентная масса металла?
Р е ш е н и е
По закону эквивалентов [из формулы (13б)]
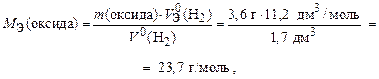
где МЭ(оксида) - это сумма МЭ(Ме) и МЭ(О), тогда МЭ(Ме) =
= МЭ(оксида) - МЭ(О) = 23, 7 – 8 = 15, 7 г/моль.
Ответ: МЭ(Ме) = 15, 7 г/моль.
Пример 14. Из 3, 31 г нитрата металла получили 2, 78 г хлорида металла. Чему равна молярная эквивалентная масса оксида металла?
Р е ш е н и е
Закон эквивалентов в данном случае примет вид
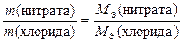 .
.
МЭ хлорида и нитрата металла можно представить таким образом:
|
|
|
МЭ(нитрата) = МЭ(Ме) + МЭ(NO  ),
),
МЭ(хлорида) = МЭ(Ме) + МЭ(Cl–).
Молярные эквивалентные массы ионов определяем по формуле (12):
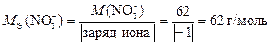 ;
;
 .
.
Тогда по закону эквивалентов
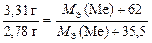 .
.
Отсюда МЭ(Ме) = 104 г/моль, а МЭ(оксида) равна
МЭ(оксида) = МЭ(Ме) + МЭ(О) = 104 + 8 = 112 г/моль.
Ответ: МЭ(оксида) = 112 г/моль.
СТРОЕНИЕ АТОМОВ И СВОЙСТВА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Краткие теоретические сведения
Атом – электронейтральная микрочастица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядро атома содержит два типа частиц (нуклонов) – протоны и нейтроны. Число протонов в ядре определяет его заряд Z, который совпадает с порядковым номером элемента в Периодической системе (ПС) Д. И. Менделеева.
Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, которое равно сумме числа протонов Z и числа нейтронов N:
А = Z + N. (14)
Атомы с одинаковыми значениями Z, но различными значениями А и N называются изотопами (например, изотопы водорода: 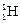 – протий,
– протий, 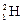 – дейтерий,
– дейтерий,  – тритий). Атомы, обладающие одинаковыми N, но различными Z и А, являются изотонами (например:
– тритий). Атомы, обладающие одинаковыми N, но различными Z и А, являются изотонами (например:  ,
, 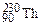 ,
,  ). Если же атомы имеют одинаковые значения А, но различаются числами Z и N, то их называют изобарами (например:
). Если же атомы имеют одинаковые значения А, но различаются числами Z и N, то их называют изобарами (например: 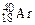 ,
,  ,
, 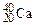 ).
).
Аr элемента, указываемая в ПС, является средней величиной массовых чисел его природных изотопов с учетом их распространенности в природе. Например, природный хлор состоит в основном из двух изотопов 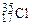 (75, 43 % атом. ) и
(75, 43 % атом. ) и 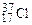 (24, 57 % атом. ), поэтому его атомная масса будет равна
(24, 57 % атом. ), поэтому его атомная масса будет равна
Ar(Cl) = 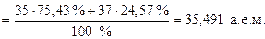
Электрон в атоме существует в виде электронного облака – определенной области пространства, которая охватывает примерно 90 % заряда и массы электрона. Эту область пространства называют орбиталью. Состояние электрона в атоме принято описывать при помощи значений четырех квантовых чисел:
|
|
|
1. Главное квантовое число n характеризует основной запас
энергии электрона и размер электронного облака. Оно может принимать только целочисленные значения от 1 до +¥. Чем больше значение n, тем больше размер электронного облака и выше его энергия. Электроны, имеющие одинаковые значения n, образуют электронные слои (иначе - энергетические уровни), которые обозначают буквами
| Значение n | |||||||
| Уровень | K | L | M | N | O | Р | Q |
2. Орбитальное (иначе побочное) квантовое число l определяет момент количества движения электрона и характеризует форму электронного облака. l изменяется в пределах от 0 до (n – 1). Каждому значению l соответствует своя форма электронного облака: при l = 0 – сферическая; l = 1 – гантелевидная; l = 2 – две пересекающиеся под прямым углом гантели; l = 3 – три пересекающиеся под прямым углом гантели (см. табл. 2).
Электроны одного энергетического уровня, имеющие одинаковые значения l, образуют энергетические подуровни, которые имеют буквенные обозначения (см. табл. 2).
Состояние электрона с определенными значениями n и l записывают в виде сочетания цифрового значения n и буквенного l. Например, при n = 3 и l = 1 записывают 3p, а при n = 4 и l = 3 записывают 4f.
3. Магнитное квантовое число ml характеризует положение электронного облака в пространстве. ml изменяется в пределах от – l до + l, т. е. всего в каждом подуровне оно может принимать (2l + 1) значений, количество которых показывает число возможных положений электронного облака данного типа в пространстве. Все орбитали одного подуровня обладают одинаковой энергией и называются вырожденными.
 Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n, l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде
Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n, l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде
 черты , которые называют энергетической ячейкой.
черты , которые называют энергетической ячейкой.

 4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ ( ) и ms = – ½ ( ).
4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ ( ) и ms = – ½ ( ).
Таблица 2
|
|
|


