 |
Примеры решения задач. Р е ш е н и е. Заряд ядра атома элемента Z = 39, значит, его порядковый номер в ПС и количество электронов также равны 39
|
|
|
|
Примеры решения задач
Пример 1. По символу изотопа элемента 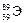 укажите название элемента, число протонов и нейтронов в его ядре, а также запишите его электронную формулу.
укажите название элемента, число протонов и нейтронов в его ядре, а также запишите его электронную формулу.
Р е ш е н и е
Заряд ядра атома элемента Z = 39, значит, его порядковый номер в ПС и количество электронов также равны 39. Следовательно, искомым элементом является иттрий 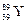 . Число протонов Z = 39, массовое число А = 89, тогда число нейтронов определяем по формуле (14):
. Число протонов Z = 39, массовое число А = 89, тогда число нейтронов определяем по формуле (14):
N = 89 – 39 = 50.
Электронная формула 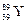 : 1s22s22p63s23p64s23d104p65s24d1.
: 1s22s22p63s23p64s23d104p65s24d1.
Ответ: Y; Z = 39; N = 50.
Пример 2. Квантовые числа валентных электронов иона Э2- равны:
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 4 1 -1 + 1/2
4 4 1 0 + 1/2
Определите порядковый номер элемента и назовите его.
Р е ш е н и е
Валентная электронная формула иона Э2–: …4s24p2. После удаления двух лишних электронов электронная конфигурация атома примет вид Э…4s2. Добавим недостающие электроны
Э: 1s22s22p63s23р64s2. Общее количество электронов равно (2 + + 2 + 6 + 2 + 6 + 2) = 20, значит, это элемент № 20 – кальций (Сa).
Пример 3. Запишите полную электронную формулу элемента с порядковым номером 23. Отметьте его валентные электроны и укажите для них значения всех квантовых чисел. К какому электронному семейству относится данный атом? Составьте электронно-графическую схему его валентных подуровней. Сколько непарных и свободных АО будет иметь ион данного атома с зарядом +2?
|
|
|
Р е ш е н и е
Элемент с № 23 – ванадий V. Составляем его электронную формулу
23V: 1s2 2s2 2p6 3s2 3p6 4s2 3d 3
Валентными электронами являются электроны 4s и 3d подуровней. Значения квантовых чисел для каждого из пяти валентных электронов равны:
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 3 2 -2 + 1/2
4 3 2 -1 + 1/2
5 3 2 0 + 1/2
Поскольку заполняются d-АО, то ванадий следует отнести к семейству d-элементов.
Составим электронно-графическую схему валентных подуровней V:
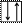
 4s 3d
4s 3d
При отрыве от атома ванадия двух электронов образуется ион V2+. Электроны покинут внешний 4s-подуровень, поэтому электронная формула V2+ примет вид:
23V2+: 1s22s22p63s23p64s03d3
После удаления электронов с 4s-АО в ионе V2+ станут свободными 3 энергетические ячейки (АО) и три АО 3d-подуровня будут заняты непарными электронами.
Пример 4. Запишите электронные формулы атома кремния в нормальном и возбужденном состояниях и определите его валентные возможности.
Р е ш е н и е
Атом кремния имеет 14-йпорядковый номер в ПС. Тогда его электронная формула в нормальном состоянии имеет вид
14Si: 1s2 2s2 2p6 3s2 3p2.
Электронно-графическая схема валентного М-слоя:
|
|
|
 3s 3p 3d
3s 3p 3d
В таком состоянии валентность Si равна В = 2, если считать, что данный атом будет образовывать ковалентные связи только по обменному механизму за счет двух непарных АО 3р-подуровня.
При возбуждении один из парных электронов 3s-орбитали переместится на подуровень 3p и электронная формула примет вид:
Si + E ® Si*: 1s2 2s2 2p6 3s1 3p3.
Электронно-графическая схема возбужденного валентного М-слоя:
 |  |  |
3s 3p 3d
В возбужденном состоянии валентность Si равна В = 4, поскольку атом имеет 4 непарных электрона. Дальнейшее возбуждение атома кремния невозможно, так как все валентные электроны атома являются непарными.
Пример 5. Укажите, как изменяются первая энергия ионизации, сродство к электрону и орбитальный радиус в ряду элементов K – Cu – Rb. Какой из перечисленных элементов является более сильным окислителем?
Р е ш е н и е
Калий и медь стоят в одном периоде, поэтому при переходе от K к Cu энергия ионизации и сродство к электрону возрастают, а орбитальный радиус уменьшается.
Калий и рубидий находятся в разных периодах, но в одной подгруппе, следовательно, при переходе от K к Rb энергия ионизации и сродство к электрону уменьшаются, а орбитальный радиус возрастает.
Наиболее сильным окислителем является тот элемент, у которого больше значение сродства к электрону. По возрастанию F элементы следует расположить в ряд: Rb ® K ® Cu. Таким образом, более сильным окислителем является медь.
Пример 6. Сравните энергии ионизации у следующих пар атомов: а) …2s2 2p3 и …2s2 2p4; б) …3s2 и …2s2 2p2. Ответ мотивируйте.
Р е ш е н и е
а) Элементы …2s2 2p3 и …2s2 2p4 располагаются в ПС в одном периоде, так как их валентные электроны имеют одинаковые значения главного квантового числа (n = 2). Кроме того, они стоят в периоде друг за другом (их электронные конфигурации отличаются на один электрон). В периоде с ростом порядкового номера энергия ионизации увеличивается. Однако I (2s2 2p3) > I (2s2 2p4), поскольку у электронной конфигурации …2s22p3 имеется наполовину заполненный p-подуровень, то есть здесь наблюдается локальный максимум энергии ионизации.
|
|
|
б) Элементы …3s2 и …2s22p2 расположены в разных периодах и группах, поэтому их нельзя сравнивать без привлечения вспомогательной конфигурации. Такой конфигурацией может служить …2s2, так как с первым элементом она стоит в одной группе (число валентных электронов одинаково и равно 2), а со вторым – в одном периоде.
I(…2s2) > I(…3s2), потому что с увеличением порядкового номера в группе происходит уменьшение энергии ионизации, а I(…2s22p2) > I(…2s2), поскольку в периоде энергия ионизации увеличивается. Таким образом, I(…2s22p2) > I(…2s2) > I(…3s2) или иначе I(…2s22p2) > I(…3s2).
Пример 7. Дайте общую характеристику элемента с порядковым номером 33. Какую высшую и низшую с. о. он проявляет в соединениях? Приведите примеры.
|
|
|


