 |
Тема: Дисперсные системы. Лабораторная работа «Свойства и получение золей»
|
|
|
|
2.Цель: Научиться получать коллоидные растворы и знать свойства золей. Научиться определять электрокинетический потенциал частиц золя методом электрофореза.
3.Задачи обучения:
Коллоидная химия изучает физико-химические свойства гетерогенных высокомолекулярных соединений в твердом состоянии и в растворах. Многие лекарственные препараты выпускают в форме эмульсии, суспензии, коллоидных растворов. Умение приготовить эти препараты, знать сроки годности и условия хранения их невозможно без знания теоретических основ коллоидной химии. Знание электрофореза, гельфильтрации и электродиализа, ультрафильтрации будет нужно непосредственно в практической работе фармацевта.
4.Основные вопросы темы:
1. Предмет коллоидной химии, ее значение в фармации.
2. Дисперсные системы. Дисперсная фаза и дисперсионная среда.
3. Классификация коллоидных систем.
4. Методы получения коллоидных систем.
5. Методы очистки коллоидных систем.
6. Оптические свойства коллоидных систем.
7. Что называется электрокинетическим потенциалом.
8. От каких факторов зависит величина потенциала.
9. Какие существуют методы определения потенциала.
10. Что такое электрофорез.
11. Как связаны электрофоретическая скорость и потенциал.
5. Методы обучения и преподавания: семинар, лабораторная работа, работа в малых группах, обучающее тестирование по теме занятия.
ЛАБОРАТОРНАЯ РАБОТА
Лабораторная работа: «Получение коллоидных растворов».
Применяемые реактивы и растворы:
Исходные реактивы для получения коллоидных систем:
FeCl3, AgNO3, KI – 0,1н.
K4[Fe(CN)6] – 0,1 н;
K4[Fe(CN)6] – насыщенный раствор;
Насыщенный раствор серы в спирте:
KMnO4 – 1,5%
Na2S2O3 – 1%
|
|
|
H2C2O4 – 1%
Применяемые приборы и оборудование:
1. Конические колбы
2. Штатив с пробирками
3. Цилиндры мерные на 50 и 100 мл.
Последовательность выполнения работы:
Опыт № 1: Получение гидрозоли серы и канифоли методом замены растворителя.
Канифоль и сера растворяются в этиловом спирте с образованием истинных растворов. Т.к. в воде сера и канифоль практически нерастворимы, то при добавлении их спиртовых растворов к воде происходит конденсация их молекул в более крупные агрегаты.
Описание опыта.
Насыщенный раствор серы в абсолютном спирте приливают по каплям в дистиллированную воду. При взбалтывании получается молочно-белый опалесцирующий золь.
Получение золя гидрата окиси железа методом гидролиза.
В пробирку с кипящей водой добавляют по каплям 2%-ный раствор хлорида железа до образования прозрачного красно-бурого золя гидрата окиси железа.
Сущность реакции.
Под действием высокой температуры реакция гидролиза хлорного железа сдвигается в сторону образования гидроокиси железа:
 FeCl3 + 3H2O Fe(OH)3 + 3HCl
FeCl3 + 3H2O Fe(OH)3 + 3HCl
Молекулы нерастворимого в воде гидрата окиси железа образуют агрегаты коллоидных размеров. Устойчивость эти агрегатам придает хлорное железо, имеющееся в растворе, причем ионы железа адсорбируются на поверхности частиц, а ионы хлора являются противоионами.
Строение получившихся мицелл схематически выражается следующей формулой:

Опыт № 2. Получение золя двуокиси марганца.
Получение золя двуокиси марганца основано на восстановлении перманганата калия тиосульфатом натрия:
 8KMnO4 + 3Na2S2O3 + H2O 8MnO2 + 3Na2SO4 + 3K2SO4 + 2KOH
8KMnO4 + 3Na2S2O3 + H2O 8MnO2 + 3Na2SO4 + 3K2SO4 + 2KOH
В присутствии избытка перманганата образуется золь марганца с отрицательно заряженными частицами:

Описание опыта:
В коническую колбу с помощью пипетки вносят 5 мл. 1,5% раствора перманганата калия и разбавляют водой до 50 мл. Затем в колбу по каплям вводят 1,5 – 2 мл раствора тиосульфата натрия. Получается вишнево-красный золь двуокиси марганца.
|
|
|
Опыт № 3. Получение золя иодистого серебра по реакции двойного обмена.
По реакции двойного обмена можно получить золь путем смешивания разбавленных растворов AgNO3 и KI. При этом необходимо соблюдать условия, чтобы одно из исходных веществ было в избытке, так как при смешивании в эквивалентных количествах реагентов образуется осадок AgI.
 AgNO3 + KI AgI + KNO3
AgNO3 + KI AgI + KNO3
Описание опыта:
В колбу наливают 2 мл. 0,1н раствора KI и разбавляют его водой до 25 мл. В другую колбу наливают 1 мл. 0,1н раствора AgNO3 и также разбавляют водой до 25 мл. Полученные растворы делят пополам и проводят два опыта:
a) постепенно приливают при взбалтывании раствор AgNO3 в раствор KI, получая золь следующего строения:

b) постепенно приливают при взбалтывании раствор AgNO3 в раствор KI, получая золь такого строения:

Опыт № 4. Получение золя берлинской лазури по реакции двойного обмена.
Соблюдая условия получения растворов по реакции двойного обмена, описанных в предыдущих опытах, получают золь берлинской лазури сначала в избытке FeCl3, затем в избытке K4[Fe(CN)6].
Описание опыта:
Опыт проводят следующим образом: к 20 мл. 0,1% K4[Fe(CN)6] прибавляют при перемешивании 5-6 капель 2% раствора FeCl3. Получают золь темно-синего цвета, мицелла которого имеет строение:
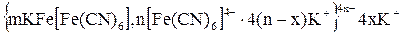
Опыт № 5. Получение золя берлинской лазури методом пептизации.
Получение коллоидного раствора берлинской лазури методом пептизации сводится к переводу в коллоидное состояние осадка K Fe[Fe(CN)6], полученного при сливании концентрированных растворов K4[Fe(CN)6] и FeCl3.
Описание опыта:
В пробирку с 5 мл. 2%-ного раствора K4[Fe(CN)6]. Полученный осадок отфильтровывают, промывают дистиллированной водой и обрабатывают осадок на фильтре 3 мл. 0,1н раствором щавелевой кислоты. В пробирку фильтруется золь берлинской лазури синего цвета.
Строение мицеллы написать самостоятельно.
6. Литература:
Евстратова К.И. и др. Физическая и коллоидная химия. М., ВШ, 1990, с. 365 – 396.
Воюцкий С.С. Курс коллоидной химии. 1980, с. 300 – 309.
Д.А.Фридрихсберг, Курс коллоидной химии, Санкт-Петербург, Химия, 1995, с.7-47,196-62
Патсаев А.К., Шитыбаев С.А., Нарманов М.М. Руководство к лабораторно-практическим занятиям по физколлоидной химии 1-часть. Шымкент, 2002г., с.24-31
Тесты по теме занятия.
|
|
|
7. Контроль:
1. Коллоиды как мыла, являются диполем, хорошо адсорбируются с частицами грязи, сообщают им заряд, способствуют их:
А) коагуляции; В) пептизации; С) коацервации;
2. Способность золя сохранять данную степень дисперсности называют:
А) седиментационной устойчивостью;
В) агрессивной устойчивостью;
С) диссолюционной устойчивостью.
3. По наличию и отсутствию взаимодействия между частицами фазы системы классифицируют на:
A) лиофильные и лиофобные;
B) молекулярнодисперсные и коллоидодисперсные;
C) свободнодисперсные и связнодисперсные.
4. Пептизация свежеприготовленного осадка гидроксида железа действием на него раствором относится FeCl3 к:
A) химической; B) адсорбционной; C) физической;
5. Способность частиц фазы не оседать под действием силы тяжести называют:
А) химической устойчивостью;
В) диссолюционной устойчивостью;
C) седиментационной устойчивостью.
6. Мицелла гидрозоля железа полученного из осадка Fe(OH)3 пептизацией раствором FeCl3 имеет форму:
A) {mFe(OH)3nFeO+(n-х)Cl-}+ххCl-;
B) {mFe(OH)3nFe+33(n-х)Cl-}+3х3хCl-;
C) {mFe(OH)33nCl-(n-х)Fe+3}-хх Fe+3.
Занятие №12
|
|
|


