 |
Синтез гетероциклических соединений реакцией Реформатского (Литературный обзор)
|
|
|
|
Содержание
Введение. 3
1.Синтез гетероциклических соединений реакцией Реформатского (Литературный обзор) 4
2. Теоретическая часть. 13
3. Экспериментальная часть. 29
Выводы.. 43
Список литературы.. 44
Приложение Анальгетическая активность синтезированных соединений. 49
Введение
Для успешного развития органической химии очень важно синтезировать новые органические соединения, принадлежащие к различным классам. Одним из путей такого синтеза является проведение реакции Реформатского, по которой можно получить органические молекулы различного состава и строения.
Хотя реакция Реформатского является лишь частью обширной и интенсивно развивающейся химии енолятов, нужно признать, что специфический способ образования цинкенолятов из галогенкарбонильных соединений, особенность их строения определяет её особое положение в данной области химии.
Огромное число всевозможных модификаций реакций, охватывающих практически все классы органических веществ, даёт право трактовать её как универсальный синтетический метод, позволяющий не только конструировать углеродный скелет, но и вводить в органические молекулы различные функциональные группы.
Синтез гетероциклических соединений реакцией Реформатского (Литературный обзор)
В 1887г. С.Н. Реформатский описал взаимодействие этилового эфира хлор- или бромуксусной кислоты с ацетоном в присутствии цинка, которое приводило к образованию β – оксикислоты. Эта реакция, вошедшая в органическую химию под названием «реакция Реформатского», выражается уравнением:

В современном понимании реакция Реформатского может быть определена как взаимодействие галогензамещенных органических соединений, содержащих электроноакцепторные группы, с цинком и электрофильными реагентами [1,2].
|
|
|

X - галогены; Y,Z – электроноакцепторные группы;
R - органический радикал; n=1,2, (3).
Все подобные реакции заключаются во внедрении цинка в связь углерод – галоген, активированную электроноакцепторной группой, которая находится чаще всего в α-положении по отношению к галогенированному углероду или отделена двойной связью. Полученный интермедиат (реактив Реформатского или промежуточно образующееся цинкорганическое соединение – ЦОС) взаимодействует практически со всеми электрофилами [3,4].
В отличие от реакций цинкорганических соединений с альдегидами и кетонами взаимодействие с хлорангидридами изучено значительно меньше. Хлорангидриды карбоновых кислот являются высокореакционными электрофильными реагентами, широко применяемыми в органическом синтезе. В реакциях мономолекулярного нуклеофильного замещения они значительно более активны, чем галогеналканы и α-хлорэфиры [5]. В то же время, значительный дробный положительный заряд на углероде карбонильной группы молекулы хлорангидрида [6] благоприятствует и атаке нуклеофильного реагента по механизму SN2. Для объяснения их высокореакционной способности было привлечено представление о специфическом геминальном взаимодействии в Cl – С = О, выражаемом передачей допольнительной электронной плотности с неподеленных пар атома кислорода карбонильной группы на разрыхляющую орбиталь С – Сl связи [5]. По отношению к амбидентным нуклеофилам хлорангидриды карбоновых кислот в соответствии с классификацией Пирсона [7,8] являются сравнительно «жесткими» электрофильными реагентами, склонными к предпочтительной атаке «жестких» нуклеофильных центров амбидентных соединений.
Реактив Реформатского, как в своем классическом варианте, так и в большинстве модифицированных реакций, рассматривается как С – металлированное производноекарбонильного типа (А). Такой вывод основан на аналогии в свойствах реактива Реформатского и реактива Гриньяра, а также на данных ЯМР спектров [9-10]. Однако имеется ряд свойств, которые находятся в согласии с енолятным типом реактива, представленного О – металлированной структурой типа (В) (отсутствие полосы поглощения карбонила сложноэфирной группы в области 17 см-1 в ИК спектре, особенности стереохимического протекания реакций и т.д.) [11-12].
|
|
|

А В
Природа растворителя очень сильно влияет на выход реактива Реформатского и определяет структуру интермедиата. На основании литературных данных [13], полученных современными физико-химическими методами исследования (ЯМР спектроскопия и рентгеноструктурный анализ), установлено, что цинкорганический реактив, образованный из α-бромэфира, в малополярных, слабосольватирующих растворителях и в твердом состоянии находится в форме ассоциата ввиде димера (С) – восьмичленного неплоского цикла с нормальными длинами ординарных Zn – О и Zn – С связей, а в высокоосновных, сильносольватирующих растворителях – в мономерной форме (D) в виде С – металлированного производного:

С D
S – эфир, бензол, ТГФ, S – ДМСО, ДМФА,
ДМЭ, ДММ ГМФТА
Согласно результатам теоретических расчетов структуры реактива Реформатского методом MNDO [13], термодинамически предпочтительная димерная структура цинкорганического соединения диссоциирует под действием карбонилсодержащего соединения на скорость определяющей стадии и переходит из С- в О-металлированный продукт.
В связи с этим реактивы Реформатского взаимодействуют с хлорангидридами карбоновых кислот в зависимости от условий реакции с образованием как О-производных [14-16], так и С-производных [16-20].
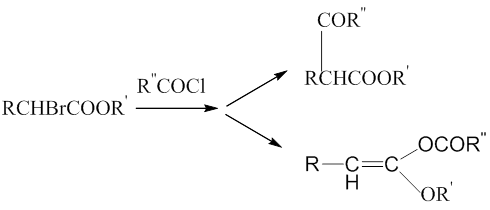
Возможности внутримолекулярных циклизаций позволяют получать оригинальные циклические структуры.
Своеобразными представителями класса лактонов, содержащих кроме лактонного фрагмента кетонную группу, являются замещённые 2,3,5,6-тетрагидропиран-2,4-дионы. Эти соединения привлекают исследователей благодоря своим практическим свойствам. Так, например, они проявляют антимикробную, противоопухолевую, гербицидную и фунгицидную активности, обладают противовоспалительным, местноанестезирующим, успокаивающим действиями, являются сильными непептидными ингибиторами ВИЧ-протеазы и т.д. [21-27]. Поэтому поиски методов получения новых типов указанных веществ представляет значительный интерес для синтетической органической химии.
|
|
|
На кафедре органической химии ПГУ разработан метод получения этих соединений.
Взаимодействие этилового эфира 4-бром-2,2,4-триметил-3-оксопентановой кислоты с альдегидами в условиях реакции Реформатского протекает следующим образом:

Единственное направление превращения цинкенолята (независимо от условий реакции и природы растворителя) – лактонизация с образованием 3,3,5,5-тетраметил-6-R-2,3,5,6-тетрагидро-2,4-пираандионов[28-33].
Использование производных циклогексан карбоновой кислоты позволило получить спиропирандионы [34-36].

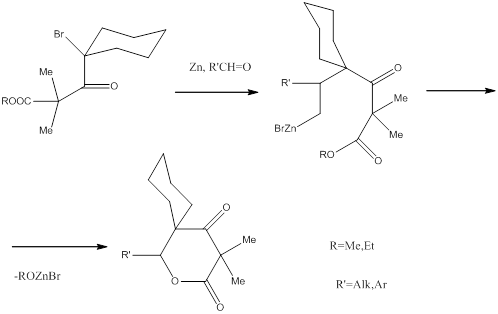
В качестве заместителей (R’) были использованы алкильные, галоген – и метоксифенильные радикалы.
Подобным же образом происходит циклизация продуктов взаимодействия реактива Реформатского, полученного из алкиловых эфиров 1-бромциклопентанкарбоновой кислоты, с альдегидами и образованиеспиропирандионов, содержащих циклопентановый цикл [37].


Метиловые эфиры 1-(1-бромциклопентилкарбонил)-, 1-(1-бромциклогексилкарбрнил)циклопентанкарбоновой кислоты или 1-(1-бромциклопентилкарбонил)циклогексанкарбоновой кислоты реагируют с цинком и ароматическими альдегидами с образованием соответствующих производныхдиспиропирандионов [38].



Представляло интерес на основе реакции Реформатского получить соединения, содержащие сложноэфирную группу.
Теоретическая часть
Целью работы явилось изучение реакции Реформатского на основе производных двухосновных карбоновых кислот.
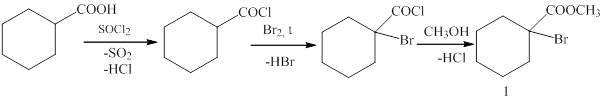
На первом этапе работы было проведено исследование взаимодействия реактива Реформатского, полученного из метилового эфира 1‑бромциклогексанкарбоновой кислоты, с метил 4-хлор-4-оксобутаноатом.
Метиловый эфир 1-бромциклогексанкарбоновой кислоты (1) был получен из циклогексанкарбоновой кислоты действием тионилхлорида с последующими бромированием и этерификацией метанолом(методика 1).
|
|
|
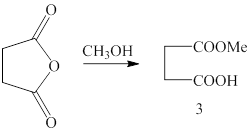
Метил 4-хлор-4-оксобутаноат получен следующим образом. Сначалабыл получен ангидрид янтарной кислоты (2) (методика 2):

Далее из ангидрида янтарной кислоты был получен монометиловый эфир янтарной кислоты (3) (методика 3):
Взаимодействие соединения (3) с тионилхлоридом привело к образованиюметил 4-хлор-4-оксобутаноата (4) (методика 4):
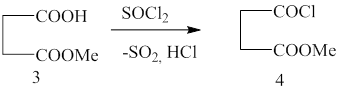
При взаимодействии метилового эфира 1-бромциклогексанкарбоновой кислоты с цинком и метил 4-хлор-4-оксобутаноатом в среде бензол-этилацетат был получен метиловый эфир 4-(1-метоксикарбонилциклогексил)-4-оксобутановой кислоты (5) (методика 5):
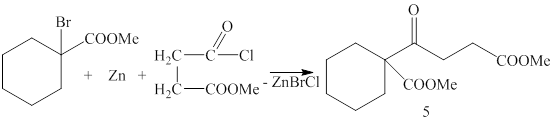
Таким образом, как и указано в литературе [17], реакция, проведенная в среде малополярных растворителей, приводит к образованию С – производного.В ИК спектре соединения (5) были обнаружены полосы поглощения валентных колебаний карбонильных групп при 1715, 1725 и1740 см-1. В ЯМР 1Н спектре наиболее характерными являются сигналы синглетов метоксильных групп при 3.62 м.д. и 3.69 м.д., триплеты метиленовых групп при 2.52 м.д. и 2.77 м.д.
Бромированием соединения (5) в среде уксусной кислоты получили метиловый эфир 3-бром-4-(1-метоксикарбонилциклогексил)-4‑оксобутановой кислоты (6) (методика 6).

В ИК спектре этого соединения обнаружены полосы поглощения валентных колебаний карбонильных групп при 1720, 1730, 1745 см-1.
В ЯМР 1Н спектре характеристическими являются синглеты метоксильных групп при 3.62 м.д. и 3.68.мд., двадвойных дублетанеэквивалентных протонов метиленовой группы при 2.61 м.д. и 3.05м.д. и триплет метинового протона при 4.91м.д.
Далее было изучено взаимодействие реактива Реформатского, полученного из соединения (6) и цинка, с ароматическими альдегидами (методики 7,8).
Как показали исследования, реактив Реформатского присоединяется к карбонильной группе ароматических альдегидов с образованием бромцинкалкоголятов (8а,b). Последние в ходе реакции циклизуются с выделением бромцинкметилата с образованием гетероциклических соединений (9а,b).

В ИК спектрах этих соединений обнаружены полосы поглощения карбонильных групп при 1700, 1735, 1780-1785 см-1. Появление полосы поглощения карбонила в области 1780-1785 см-1 указывает на то, что в результате циклизации образовался не шестичленный пираноновый цикл, а пятичленный фураноновый цикл (частота колебания карбонила в тетрагидропиран -2 -оне - ≈ 1735см-1, а в тетрагидрофуран - 2- оне - ≈ 1770 см-1 [39]). Таким образом, полученные соединения являются метил 1-(2-арил-5-оксотетрагидрофуран-3-карбонил)циклогексанкарбоксилатами (9а,b), а не метил 2-(3-арил-1,5-диоксо-2-оксаспиро[5.5]унлекан-4-ил)этаноатами (10а,b).
|
|
|
С целью более точного установления структуры синтезированных соединений был проведен рентгеноструктурный анализ соединения 9а.
По данным РСА[1] соединение кристаллизуется в центросимметричной пространственной группе. Общий вид и принятая в структурном эксперименте нумерация атомов приведены на рис. 1. Длины связей и валентные углы соединения не демонстрируют существенных отклонений от нормы. Длина связей карбонильных групп СООR-фрагментов равна 1.192(3) Å, С=О связи кетогруппы – 1.211(3) Å, связи Br-C – 1.900(2) Å. Циклогексильный фрагмент имеет конформацию «кресло» с аксиальным расположением СООМе-группы, тетрагидрофураноновый цикл – конформацию конверта с выведением из плоскости атома С(3) (рис.1.) и транс-расположением заместителей при атомах С(2) и С(3). Значимоукороченные межмолекулярные контакты в кристаллической упаковке отсутствуют.
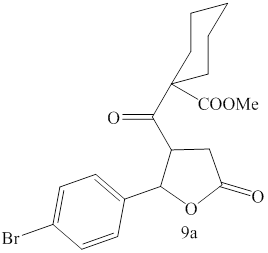

Рис.1. Соединение 9а в тепловых эллипсоидах 50 % вероятности.
С целью объяснения регионаправленности процесса мы провели неэмпирические расчеты геометрических и электронных характеристик возможных интермедиатов (Ar = p -BrС6Н4) методом B3LYP/6-31(d)[2]. Рассчитанные величины полных энергий (Е, а.е.) возможных интермедиатов и продуктов реакции приведены на схеме 2. Реактив Реформатского полученный из цинка и (6), по-видимому, существуетв форме цинк-енолята, и стабилизован за счет координации атома цинка с атомом кислорода одной из карбонильных группы сложноэфирных фрагментов (интермедиаты 6′ и 6′′). Как оказалось интермедиат 6′′ оказался более стабильным (на 5.5 кДж/моль).
Присоединение ароматического альдегида к реактиву Реформатского, приводит к интермедиату 7a, который стабилизируется за счет координации атома цинка с атомом кислорода кетонного карбонила. Далее интермедиат 7a превращается в интермедиат 8′a, поскольку замыканию фуранового цикла должна способствовать координация атома цинка с атомом кислорода сложноэфирного карбонила; предшественником пирандионов 10а, b должен быть интермедиат 8″.
Как показывают расчеты интермедиат 8′a оказывается формально стабильнее интермедиата 8″a на 6.3 кДж/моль и его образование можно считать более предпочтительным. Отщепление молекулы бромцинкметилата от интермедиата 8′a приводит к замещенному фуранону 9а. Пирандион 10а, образование которого возможно в случае реализации альтернативного пути 7 a → 8″a → 10а, также оказался менее стабильным, чем реально образующийся фуранон 9а, на 9.7 кДж/моль [40].

В продолжение исследований было изучено взаимодействие реактива Реформатского, полученного из метилового эфира 1-бромциклопентанкарбоновой кислоты и цинка, с метил 4-хлор-4-оксобутаноатом. Сначала из циклогексанона был получен 2-хлорциклогексанон (11) (методика 9).

Перегруппировкой Фаворского при действии спиртового раствора гидроксида натрия на 2‑хлорциклогексанонбыла синтезирована циклопентанкарбоновая кислота (12) (методика 10).

Аналогично (1), из циклопентанкарбоновой кислоты действием тионилхлорида с последующим бромированием и этерификацией метанолом был получен метиловый эфир 1-бромциклопентанкарбоновой кислоты (13) (методика 11).

Взаимодействие метилового эфир 1-бромциклопентанкарбоновой кислоты с цинком и метил 4-хлор-4-оксобутаноатом привело к образованию метил 1-(4-метокси-4-оксобутаноил)циклопентанкарбоксилата (14) (методика 12). В ИК спектре соединения (14) были обнаружены полосы поглощения валентных колебаний карбонильных групп при 1716, 1725 и 1744 см-1. В ЯМР 1Н спектре наиболее характерными являются синглеты метоксильных групп при 3.62 м.д. и 3.73 м.д., триплеты метиленовых групп при 2.51 м.д. и 2.79 м.д.

Бромированием соединения (14) был получен метил 1-(2-бром-4-метокси-4-оксобутаноил)циклопентанкарбоксилат (15) (методика 13).

В ИК спектре соединения (15) обнаружены полосы поглощения валентных колебаний карбонильных групп при 1723, 1732, 1745 см-1.
В ЯМР 1Н спектре наиболее характерными являются синглеты метоксильных групп при 3.64 м.д. и 3.70 м.д., двадвойных дублета неэквивалентных протонов метиленовой группы при 2.61 м.д. и 3.07 м.д. и триплет метинового протона при 4.97м.д.
При взаимодействии метил 1-(2-бром-4-метокси-4-оксобутаноил)циклопентанкарбоксилата с цинком и 4-бромбензальдегидом (методика 14) выделено соединение, в ИК спектре которого обнаружены полосы поглощения карбонильных групп при 1710, 1735, 1790 см-1, Это позволяет сделать вывод, что в результате реакции образуется, через переходное соединение (16), соединение с фураноновым циклом, а именно метил 1-[2-(4-бромфенил)-5-оксотетрагидрофуран-3-карбонил]циклопентанкарбоксилат (17).

Следующим объектом исследования реакции Реформатского на основе эфиров бромоксодикарбоновых кислот стал метил 2-бром-2-(3-метокси-2,2-диметил-3-оксопропаноил)циклогексанкарбоксилат.
Последовательным действием на изомасляную кислоту тионилхлорида, брома и метанола был получен метил 2-бром-2-метилпропаноат (18) (методика 15).

Нагреванием ангидрида циклогексан-1,2-дикарбоновой кислоты с безводным метанолом был получен монометиловый эфир циклогексан-1,2-дикарбоновой кислоты (19) (методика 16), который под действием тионилхлорида был синтезирован в метил 2-(хлоркарбонил)циклогексанкарбоксилат (20) (методика 17).

При взаимодействии метил 2-бром-2-метилпропаноата с цинком и метил 2-(хлоркарбонил)циклогексанкарбоксилатом был выделен метил 2‑(3‑метокси-2,2-диметил-3-оксопропаноил)циклогексан-1-карбоксилат (21) (методика 18).

В ИК спектре полученного соединения зафиксированы полосы поглощения валентных колебаний карбонильных групп при 1710 и 1725 см-1. В ЯМР 1Н спектре присутствуют сигналы протонов циклогексильного кольца в области 1.05-2.28 м.д., синглеты метоксильных групп при 3.56 и 3.66 м.д., мультиплеты метиновых протонов при 2.67 и 3.04 м.д., синглеты метильных групп при 1.37 и 1.45 м.д.
Бромирование метил 2-(3-метокси-2,2-диметил-3-оксопропаноил)циклогексан-1-карбоксилата в присутствии уксусной кислоты привело к образованию метил 2-бром-2-(3-метокси-2,2-диметил-3-оксопропаноил)циклогексан-1-карбоксилата (22) (методика 19). В ИК спектре соединения (22) обнаружены полосы поглощения валентных колебаний карбонильных групп при 1718, 1733, 1744 см-1.
В ЯМР 1Н спектре наиболее характерными являются синглеты метоксильных групп при 3.62 м.д. и 3.71 м.д. и синглетыметильных групп при 1.39 и 1.48 м.д.
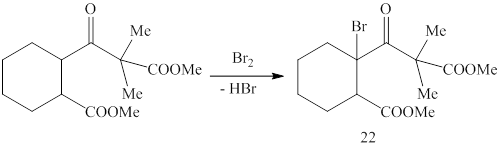
При взаимодействие реактива Реформатского, полученного из метил 2‑бром-2-(3-метокси-2,2-диметил-3-оксопропаноил)циклогексан-1-карбоксилата и цинка, с 4-бромбензальдегидом (методика 20) выделить кристаллических продуктов не удалось, вследствие сильного осмоления реакционной массы.
Так как взаимодействие реактивов Реформатского, полученных из диэфиров бромоксодикарбоновых кислот и цинка, приводит к образованию фуранонового цикла, с целью получения спирогексагидропирандионов со сложноэфирной группой в качестве исходного соединения для получения реактива Реформатского был разработан метод получения бромцинковых солей моноэфиров бромоксодикарбоновых кислот.
Эти исходные соединения были получены следующим образом. Сначала было изучено взаимодействие реактивов Реформатского, полученных из метиловых эфиров 1-бромциклопентан- и 1‑бромциклогексанкарбоновых кислот и цинка, с ангидридами янтарной и циклогексан-1,2-дикарбоновой кислотами. Как показали наши исследования, реактивы Реформатского присоединяются к одной из карбонильных групп янтарного ангидрида, образуя интермедиаты (23,24), и после разложения реакционной массы были выделены 4-[1-(метоксикарбонил)циклопентил]-4-оксобутановая (25) и 4-[1-(метоксикарбонил)циклогексил]-4-оксобутановая (26) кислоты (методики 21,22).

Подобным же образом реактивы Реформатского, полученные из метиловых эфиров 1-бромциклопентан- и 1-бромциклогексанкарбоновых кислот и цинка, а также реактив Реформатского, полученный из метилового эфира α-бромизомасляной кислоты и цинка, присоединяются к карбонильной группе ангидрида цис -циклогексан-1,2-дикарбоновой кислоты с образованием интермедиатов (27-29), и в результате были выделены 2-[1-(метоксикарбонил)циклопентанкарбонил]циклогексанкарбоновая (30), 2-[1-(метоксикарбонил)циклогексанкарбонил]циклогексанкарбоновая (31) и 2-(3-метокси-2,2-диметил-3-оксопропаноил)циклогексанкарбоновая (32) кислоты (методики 23-25).

Строение синтезированных соединений подтверждено данными ИК и ЯМР 1Н спектроскопии. В ИК спектрах синтезированных соединений присутствуют полосы поглощения в области 1739-1714, принадлежащие карбонильным группам сложного эфира, и уширенная полоса в области 1682-1727 см-1, принадлежащая карбонилам кетонных и карбоксильных групп, связанных водородными связями, а также широкие полосы поглощения в области 3100-3300 см-1, принадлежащие валентным колебаниям связанных водородными связями гидроксильных групп [41].
Синтезированные соединения (25, 26, 30-32) обладают анальгетической активностью выше эталонного препарата анальгина (приложение).
Далее было произведено бромирование 4-(1-метоксикарбонилциклогексил)-4-оксобутановой кислоты (26) в среде уксусной кислоты, в результате выделена 3-бром-4-(1-метоксикарбонилциклогексил)-4-оксобутановая кислота (33)(методика 26):

В ИК спектре этого соединения обнаружены полосы поглощения валентных колебаний кетонной группы, карбонилов в карбоксильной группе и в сложном эфире при 1705,1720 и 1740 см-1 соответственно.
В ЯМР 1Н спектре присутствуют сигналы протонов циклогексильного кольца в области 1.10-2.36 м.д., синглет метоксильной группы при 3.63 м.д., синглет протона гидроксильной группы при 11.16 м.д., два двойныхдублетанеэквивалентных протонов метиленовой группы при 2.88 и 3.25 м.д. и триплет метинового протона при 4.82 м.д.
Бромцинковую соль кислоты (33) синтезировали следующим образом. Бромированием 2-метил-1-фенилпропан-1-она был получен 2-бром-2-метил-1-фенилпропан-1-она (34) (методика 27), который с цинком дает реактив Реформатского, образующий с соединением (33) соответствующую соль (35) (методика 28).
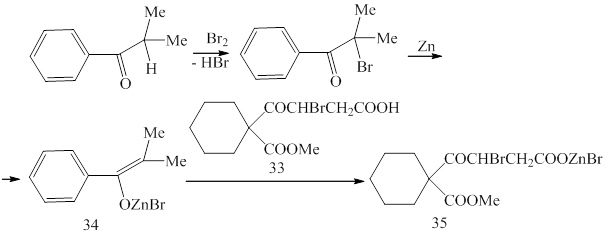
При взаимодействии соли (35) с цинком и 4-бромбензальдегидом было выделено соединение (36). В ИК спектре этого соединения обнаружены полосы поглощения при 1697, 1681 и 1653 см-1. В ЯМР 1Н спектре присутствуют сигналы протонов циклогексильного кольца в области 1.05-2.05 м.д., синглет метиленовой группы при 3.42 м.д., Два дублета 4-бромфенильной группы при 7.20, 7.48 м.д.,синглет протона у углерода с двойной связью при 7.53 м.д., синглет протона гидроксильной группы при 11.20 м.д. Это позволяет сделать вывод, что была выделена 3-(4-бромбензилиден)-4-(1-метоксикарбонилциклогексил)-4-оксобутановая кислота, то есть не происходит циклизация интермедиата (А), а с отщеплением основной соли цинка идет образование соответствующего непредельного соединения (36).

Подобное образование непредельных соединений было зафиксировано в работе [42]. Образованию двойной связи способствует наличие нескольких электроноакцепторных групп в интермедиате (А).
Далее были изучены реакции с производными глутаровой кислоты. Метил 5-хлор-5-оксопентаноат (37) был получен по следующей схеме (методики 29-31):

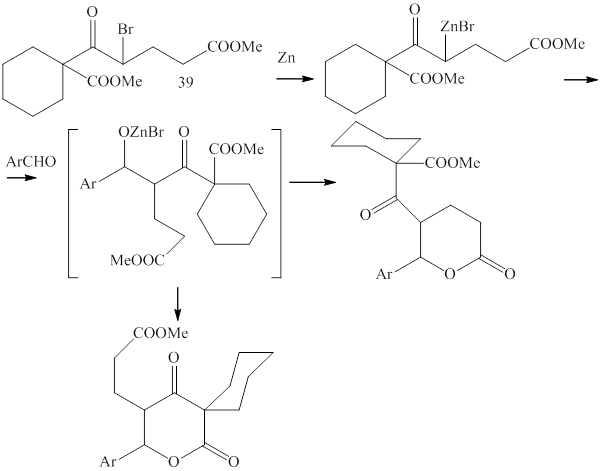
При взаимодействии метилового эфира 1-бромциклогексанкарбоновой кислоты с цинком и метил 5-хлор-5-оксопентаноатом был выделен метиловый эфир 5-(1-метоксикарбонилциклогексил)-5-оксопентановой кислоты (38) (методика 32).

В ИК спектре соединения (38) обнаружены полосы поглощения валентных колебаний карбонильных групп при 1715 и 1730 см-1. В ЯМР 1Н спектре присутствуют сигналы протонов циклогексильного кольца в области 1.10-1.70 м.д., мультиплеты метиленовых групп при 1.93, 2.38 и 4.07 м.д. и синглеты метоксильных групп при 3.62 и 3.67 м.д.
Бромированием соединения (38) синтезировали метиловый эфир 4-бром-5-(1-метоксикарбонилциклогексил)-5-оксопентановой кислоты (39) (методика 33):

В ИК спектре этого соединения присутствуют полосы поглощения валентных колебаний карбонильных групп при 1712, 1724 и 1735 см-1. В ЯМР 1Н зафиксированы сигналы метиленовых протонов в области 1.10-2.95 м.д., синглеты метоксильных групп при 3.61 и 3.69 м.д. и триплет метинового протона при 4.93 м.д.
При взаимодействии соединения (39) с цинком и ароматическими альдегидами (методика 34,35) выделить кристаллические продукты не удалось. Вероятно, образуются смеси продуктов реакции, так как интермедиат (В) может циклизоваться двумя путями, давая в том и другом случае пирановые циклы:
Ar = (4-BrC6H4, 4-ClC6H4)
|
|
|


