 |
Значение периодической системы
|
|
|
|
Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
· все вещества реагируют в эквивалентных отношениях.
· формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества
Молярная масса эквивалентов обычно обозначается как 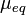 или
или 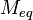 . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как
. Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как 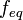 ).
).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M
Фактор эквивалентности
Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как 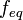 ).
).
Число эквивалентности
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности 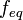 связан с числом эквивалентности z следующим соотношением:
связан с числом эквивалентности z следующим соотношением: 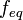 =1/z.
=1/z.
Например, в реакции:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2
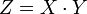
8Определение атомных масс. Валентность.
Так, при взаимодействии 1 объема хлора с 41 объемом водорода образуются 2 объема хлороводорода. Из этого следует, что молекула хлора, как и молекула водорода, состоит из 2-х атомов. Аналогично было установлено, что молекулы других простых газов, таких, как кислород, азот также двухтомны. Атомную массу перечисленных газов находят делением их молекулярной массы на 2.
Например, молекулярная масса хлора равна 71, следовательно, его атомная масса 35,5. О количестве атомов, входящих в состав молекул, можно также судить по их молярной теплоемкости. Именно по результатам измерения этой характеристики благородных газов было установлено, что их молекулы одноатомны и атомная масса этих газов равна их молекулярной массе. | |||||
| |||||
Атомную массу элемента можно рассчитать, исходя из положения этого элемента в Периодической системе. Приблизительную атомную массу элемента можно вычислить как среднеарифметическое атомных масс соседних с ним элементов. Так атомная масса алюминия, рассчитанная как среднеарифметическое атомных масс магния, кремния, бора и скандия равна Ar(Mg)+Ar(Si)+ Ar(B)+ Ar(Sc))/4=(24,3+28,08+10,8+44,95)/4=27,03 | |||||
|
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году(нем. Valenz).[1] В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества
|
|
|
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт
В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 годуВ. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4- и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
9 Важнейшие классы и номенклатура неорганических веществ.
Эквивалент – такое количество вещества (элемента), которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Это величина безразмерная, непостоянная, зависит от ряда факторов: валентности, реакций, в которых участвует вещество:
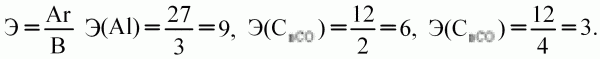
В окислительно-восстановительных реакциях:
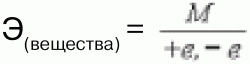
Эквивалент в реакциях нейтрализации зависит от того, какая соль получается в результате реакции (средняя или основная).
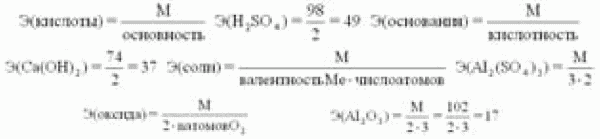
или

Закон эквивалентов открыт в 1873 году Рихтером: вещества взаимодействуют друг сдругом, а также получаются в массовых количествах, пропорциональных их эквивалентам.
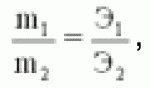
где m1 и m2 – массы веществ, Э – эквиваленты.
Неорганические вещества делятся на простые (металлы и неметаллы) и сложные (оксиды, основания, кислоты, соли).
|
|
|
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород, бывают несолеобразующие (N2O) и солеобразующие (основные (К2О), кислотные (SО2), амфотерные (Al2O3). Основания – электролиты, которые при диссоциации образуют только гидроксид-ионы, бывают растворимые (щелочи: NаОН, Ва(ОН)2), нерастворимые (Fe(OH)2), амфотерные (Аl(ОН)3). Кислоты – электролиты, которые при диссоциации образуют катионы водорода, бывают сильные (Н2S O4, НNO3), слабые (НBr), одноосновные (НСl), многоосновные (Н2СО3, Н3РО4), кислородосодержащие (Н2SO4, НСlО), бескислородные (НI, НСN). Соли – электролиты, при диссоциации которых образуются катионы металлов или катион аммония NН4, анионы кислотных остатков, бывают средние (К2SO4, Сu(NO3)2), кислые (КНSO4, NаНСО3), основные (СuОНСl, FeOHSO4), двойные (КМnO4, СаZnO2), комплексные (К4[Fe(CN)6]), растворимые (NаСl, К2SO4) и нерастворимые (ВаSO4, АgСl).
10 Периодический закон Д.И.Менделеева — фундаментальный закон природы, открытыйД. И. Менделеевым в 1869 году при сопоставлении свойств известных в то времяхимических элементов и величин их атомных масс.
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». [1]
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1911), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.).
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
|
|
|
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная МенделеевымПериодическая система элементов.
Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании».
В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный).
Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
В системе 10 рядов. Каждый малый период состоит из одного ряда, каждый большой период — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от К до Mn изменяются от +1 до +7, затем следует триада Fe, Со, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая седьмой, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов.
В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает подобные лантану”, а “актиноиды” — “подобные актинию”). Иногда их называют лантанидами и актинидами, что означает следующие за лантаном, следующие за актинием). Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе: La-Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия.
|
|
|
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе: Ас-Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.
В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона.
В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения.
Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе -подчеркивается смещением одних вправо, а других влево. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы— элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля.
Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, С1, Вг, I, Аt, побочную — металлы Мn, Тc, Rе. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RО, R2O3, RO2, R2O5, RО3, R2O7, RO4, где R — элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы (главной и побочной), кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения, форм таких соединений 4. Их также изображают общими формулами в последовательности RН4, RН3, RН2, RН. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.
Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические — у фтора, затем — у кислорода.
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем Уровне имеют2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов.
Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Li, Na, К, Rb, Cs); (Ве, Mg, Са, Sr); (F, Сl, Вг, I); (Не, Nе, Аг, Kr, Хе) и т. д. Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, К, Rb, Cs в I группе, F, Сl, Вг, I — в VII и т. д. Именно вследствие сходства строения электронных оболочек атомов сходны их физические и химические свойства.
Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Со-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8.
По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т. е. 14.
Период начинается элементом, в атоме которого на внешнем уровне находится один s-электрон: в первом периоде это водород, в остальных — щелочные металлы. Завершается период благородным газом: первый — гелием (1s2), остальные периоды — элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns2np6.
Первый период содержит два элемента: водород (Z=1) и гелий (Z= 2). Второй период начинается элементом литием (Z= 3) и завершается неоном (Z = 10). Во втором периоде восемь элементов. Третий период начинается с натрия (Z= 11), электронная конфигурация которого 1s22s22p63s1. С него началось заполнение третьего энергетического уровня. Завершается оно у инертного газа аргона (Z = 18), Зs- и 3p-подуровни которого полностью заполнены. Электронная формула аргона: 1s22s22p6Зs23p6. Натрий — аналог лития, аргон — неона. В третьем периоде, как и во втором, восемь элементов.
Четвертый период начинается калием (Z= 19), электронное строение которого выражается формулой 1s22s22p63s23p64s1. Его 19-й электрон занял 4s-подуровень, энергия которого ниже энергии Зd-подуровня. Внешний 4s-электрон придает элементу свойства, сходные со свойствами натрия. У кальция (Z = 20) 4s-подуро-вень заполнен двумя электронами: 1s22s22p63s23р64s2. С элемента скандия (Z = 21) начинается заполнение Зd-подуровня, так как он энергетически более выгоден, чем 4р-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z = 30). Поэтому электронное строение Sc соответствует формуле 1s22s22p63s23p63d14s2, а цинка - 1s22s22p63s23p63d104s2. В атомах последующих элементов вплоть до инертного газа криптона (Z=36) идет заполнение 4p-подуровня. В четвертом периоде 18 элементов.
Пятый период содержит элементы от рубидия (Z=37) до инертного газа ксенона (Z = 54). Заполнение их энергетических уровней идет так же, как у элементов четвертого периода: после Rb и Sr у десяти элементов от иттрия (Z = 39) до кадмия (Z=48) заполняется 4d-подуровень, после чего электроны занимают 5p-подуровень. В пятом периоде как и в четвертом, 18 элементов.
В атомах элементов шестого периода цезия (Z= 55) и бария (Z = 56) заполняется 6s-подуровень. У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-поАуровень, семь орбиталей которого могут быть заняты 14 электронами. Это происходит у атомов элементов лантаноидов с Z = 58 — 71. Поскольку у этих элементов заполняется глубинный 4f-подуровеиь третьего снаружи уровня, они обладают весьма близкими химическими свойствами. С гафния (Z = 72) возобновляется заполнение d-подуровня и заканчивается у ртути (Z = 80), после чего электроны заполняют 6p-подуровень. Заполнение уровня завершается у благородного газа радона (Z= 86). В шестом периоде 32 элемента.
Седьмой период — незавершенный. Заполнение электронами электронных уровней аналогично шестому периоду. После заполнения 7s-подуровня у Франция (Z = 87) и радия (Z = 88) электрон актиния поступает на 6d-подуровень, после которого начинает заполняться 5f-подуровень 14 электронами. Это происходит у атомов элементов актиноидов с Z = 90 — 103. После 103-го элемента идет заполнение б d-подуровня: у курчатовия (Z = 104), нильсбория(Z = 105), элементов Z = 106 и Z = 107. Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами.
Хотя 3 d-подуровень заполняется после 4s-подуровня, в формуле он ставится раньше, так как последовательно записываются все подуровни данного уровня.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
1. s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого).
3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами).
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
Периодическая система Д. И. Менделеева является естественной классификацией химических элементов по электроны структуре их атомов. Об электронной структуре атома, а значит, и свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах.
Таким образом, строгая периодичность расположения элементов в периодической системе химических элементов Д. И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) —классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химикомД. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Значение периодической системы
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Разработанная в XIX в. в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики, получивших развитие в начале XX в. — физики атома и физики ядра. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный номер) является меройэлектрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет числоэлектронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.
Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
13 РАДИОАКТИВНОСТЬ
самопроизвольное превращение атомов одного элемента в атомы других элементов, сопровождающееся испусканием частиц и жесткого электромагнитного излучения. Историческая справка. Беккерель. Весной 1896 французский физик А.Беккерель сделал ряд сообщений об обнаружении им нового вида излучения (впоследствии названном радиоактивным), которое испускается солями урана. Подобно открытым за несколько месяцев до этого рентгеновским лучам, оно обладало проникающей способностью, засвечивало экранированную черной бумагой фотопластинку и ионизировало окружающий воздух. Гипотеза, которая привела к открытию радиоактивности, возникла у Беккереля под влиянием исследований Рентгена. Поскольку при генерации Х-лучей наблюдалась фосфоресценция стеклянных стенок рентгеновской трубки, Беккерель предположил, что любое фосфоресцентное свечение сопровождается испусканием рентгеновского излучения. Для проверки этого предположения он поместил различные фосфоресцирующие вещества на завернутые в черную бумагу фотопластинки и получил неожиданный результат: засвеченной оказалась единственная пластинка, с которой соприкасался кристалл соли урана. Многочисленные контрольные опыты показали, что причиной засветки явилась не фосфоресценция, а именно уран, в каком бы химическом соединении он ни находился. Свойство радиоактивного излучения вызывать ионизацию воздуха позволило наряду с фотографическим методом регистрации применять более удобный электрический метод, что значительно ускорило процесс исследований.
Кюри. Пользуясь электрическим методом, Г. Шмидт и М. Кюри в 1898 обнаружили радиоактивность элемента тория. В следующем году Дебьерн открыл радиоактивный элемент актиний. Начатый супругами П. и М.Кюри систематический поиск новых радиоактивных веществ и изучение свойств их излучения подтвердили догадку Беккереля о том, что радиоактивность урановых соединений пропорциональна числу содержащихся в них атомов урана. Среди обследованных минералов эту закономерность нарушала лишь урановая смоляная руда (уранинит), которая оказалась в четыре раза активнее, чем соответствующее количество чистого урана. Кюри сделали вывод о том, что в уранините должен содержаться неизвестный высокоактивный элемент. Проведя тщательное химическое разделение уранинита на составляющие компоненты, они открыли радий, по химическим свойствам сходный с барием, и полоний, который выделялся вместе с висмутом.
Резерфорд. В дальнейших исследованиях радиоактивности ведущая роль принадлежала Э. Резерфорду. Сосредоточив внимание на изучении этого явления, он установил природу радиоактивных превращений и сопутствующего им излучения.
Излучение радиоактивных веществ. Естественные радиоактивные элементы испускают три вида излучений: альфа, бета и гамма. В 1899 Резерфорд идентифицировал альфа- и бета-излучение; спустя год П.Вийар открыл гамма-излучение.
Альфа-излучение. В воздухе при атмосферном давлении альфа-излучение преодолевает лишь небольшое расстояние, как правило, от 2,5 до 7,5 см. В условиях вакуума электрическое и магнитное поля заметно отклоняют его от первоначальной траектории. Направление и величина отклонений указывают на то, что альфа-излучение - это поток положительно заряженных частиц, для которых отношение заряда к массе (e/m) в точности соответствует дважды ионизированному атому гелия (He++). Эти данные и результаты спектроскопического исследования собранных альфа-частиц позволили Резерфорду сделать вывод о том, что они являются ядрами атома гелия.
Бета-излучение. Это излучение обладает большей проникающей способностью, чем альфа-излучение. Как и альфа-излучение, оно отклоняется в магнитном и электрическом полях, но в противоположную сторону и на большее расстояние. Это указывает на то, что бета-излучение является потоком отрицательно заряженных частиц малой массы. По отношению e/m Резерфорд идентифицировал бета-частицы как обычные электроны.
Гамма-излучение. Гамма-излучение проникает в вещество гораздо глубже, чем альфа- и бета-излучения. Оно не отклоняется в магнитном поле и, следовательно, не имеет электрического заряда. Гамма-лучи были идентифицированы как жесткое (т.е. имеющее очень высокую энергию) электромагнитное излучение. Разделение радиоактивного излучения в магнитном поле на альфа-, бета- и гамма-лучи схематично показано на рисунке.
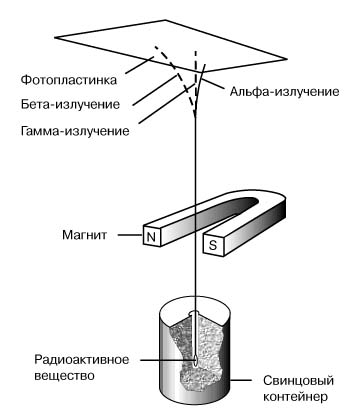
СХЕМА ЭКСПЕРИМЕНТА, иллюстрирующего отклонение разных видов радиоактивного излучения в магнитном поле.
Теория радиоактивного распада. В процессе эмиссии радиоактивного излучения вещество претерпевает ряд изменений. Так, например, излучение радия сопровождается выделением газообразного радона ("эманацией"). В свою очередь радон, распадаясь, оставляет радиоактивные отложения на стенках содержащего его сосуда. Собранная при распаде радия эманация теряет половину исходной активности примерно за 4 сут. Эти и другие не поддававшиеся интерпретации экспериментальные факты удалось объяснить с помощью теории радиоактивного распада атомов, предложенной Резерфордом и Содди в 1903, а также правила смещения, сформулированного в 1913 А.Расселом и независимо от него Фаянсом и Содди. Суть теории Резерфорда и Содди состоит в том, что в результате радиоактивного распада происходит превращение одного химического элемента в другой.
Правило смещения. Правило смещения точно указывает, какие именно превращения претерпевает химический элемент, испуская радиоактивное излучение.
Эмиссия альфа- и бета-частиц. Правило смещения можно пояснить с помощью ядерной модели атома, предложенной Резерфордом в 1911. Согласно этой модели, в центре атома находится положительно заряженное ядро, в котором сосредоточена основная часть массы атома. Вокруг ядра вращаются электроны, заряд которых компенсирует положительный заряд ядра. Каждому атому приписывается свой атомный номер Z, соответствующий его порядковому номеру в периодической таблице Менделеева и численно равный заряду ядра, выраженному в единицах заряда электрона. Альфа-частица имеет Z = 2 и массовое число (округленный атомный вес) A = 4. Если неустойчивое ядро испускает бета-частицу, то его Z увеличивается на единицу, а массовое число не изменяется. Следовательно, радиоактивный атом превращается в следующий по порядку атом таблицы Менделеева. При эмиссии альфа-частицы Z и A вновь образованного ядра уменьшаются на 2 и 4 единицы соответственно, а дочерний атом, испытав соответствующее изотопическое превращение, "смещается" в таблице Менделеева влево от родительского элемента.
Гамма-излучение. Орбитальные электроны, получив избыток энергии, могут переходить на более высокие энергетические уровни. Возвращаясь в основное (нормальное) состояние, они отдают избыток энергии в виде света или рентгеновского излучения. Ядра атомов, обладающие избыточной энергией, также могут переходить в возбужденное состояние. Подобное возбуждение часто испытывают ядра, образующиеся в процессе радиоактивных превращений. Переходя в основное состояние, они излучают избыток энергии в виде гамма-квантов. Особый интерес представляет вариант распада, когда радиоактивное ядро имеет большое время жизни возбужденного состояния. В этом случае у находящихся в разных энергетических состояниях одинаковых ядер (с одинаковыми значениями Z и A) наблюдаются однотипные радиоактивные распады, но происходят они с разными скоростями, поскольку одни ядра распадаются из возбужденного, а другие из основного состояния. Это явление получило название ядерной изомерии, а возбужденное и нормальное ядра называются изомерами.
Радиоактивные ряды. Правило смещения позволило проследить превращения естественных радиоактивных элементов и выстроить из них три генеалогических дерева, родоначальниками которых являются уран-238, уран-235 и торий-232. Каждое семейство начинается с чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство, например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5*10 9 лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
Таблица 1.
РАДИОАКТИВНОЕ СЕМЕЙСТВО УРАНА
Период полураспада. Важнейшей характеристикой радиоактивного атома является его время жизни. Согласно закону радиоактивного распада, вероятность того, что за данный промежуток времени произойдет распад одного атома, есть величина постоянная. Следовательно, число ежесекундно происходящих распадов пропорционально количеству имеющихся атомов, а закон, описывающий процесс распада, имеет экспоненциальный характер. Если за время Т распадается половина исходного количества радиоактивных атомов, то половина оставшихся атомов распадется в течение следующего промежутка времени той же длительности. Время Т называется периодом полураспада радиоактивного элемента. Для различных элементов период полураспада составляет от десятков миллиардов лет до миллионных долей секунды и менее.
14 Ядерная модель атома.
Представление об атомах как неделимых мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых была доказана реальность существования атомов. Но вопрос об их внутреннем устройстве даже не возникал, и атомы по-прежнему считались неделимыми частицами. В XIX веке изучение атомистического строения вещества существенно продвинулось вперед. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц – ионов. Фарадей определил минимальный заряд иона, который был названэлементарным электрическим зарядом. Его приближенное значение оказалось равным e = 1,60·10–19 Кл.
Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежитДж. Томсону. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис. 6.1.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
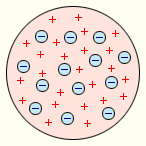
|
| Рисунок 6.1.1. Модель атома Дж. Томсона |
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардиро
|
|
|



