 |
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
|
|
|
|
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй – два (s,p), третий – три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и (f). Сферическую атомную орбиталь ученые договорились называть s -орбиталью. Она самая устойчивая и располагается довольно близко к ядру.

|
| S – орбиталь |
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p -орбиталь:

Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
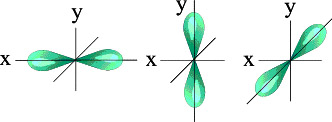
|
| Три p – орбитали |
Итак, p -орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составить схему последовательного заполнения электронами энергетических уровней
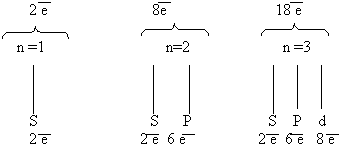
Теперь мы можем составить схему строения электронных оболочек атомов:
1. Определяем общее число электронов на оболочке по порядковому номеру элемента.
2. Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
3. Определяем число электронов на каждом энергетическом уровне.
4. Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
|
|
|
На s -подуровне может находиться одна атомная орбиталь

а на p - подуровне их может быть уже три –
(в соответствии с тремя осями координат):
Орбиталей d – и f - подуровня в атоме может быть уже пять и семь соответственно:

Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
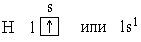
Чтобы установить связь между строением атома химического элемента и его свойствами, рассмотрим еще несколько химических элементов.
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:

Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается завершенным.
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.

Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:

Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:

Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь этим правилом, нетрудно составить схему электронного строения для атома азота:
|
|
|

Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
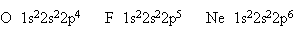
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Если элементы имеют одинаково устроенные внешние энергетические уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон – газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
17 Энергетическое состояние электрона в атоме в телефоне
Главное квантовое число
Материал из Википедии — свободной энциклопедии
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризуетэнергию электронов, занимающих данный энергетический уровень. Является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовых числа определяют уникальное состояние электрона в атоме (его волновую функцию). Главное квантовое число обозначается как  . При увеличении главного квантового числа возрастают радиус орбиты и энергия электрона.Главное квантовое число равно номеру периода элемента.
. При увеличении главного квантового числа возрастают радиус орбиты и энергия электрона.Главное квантовое число равно номеру периода элемента.
|
|
|
Наибольшее число электронов на энергетическом уровне с учётом спина электрона определяется по формуле 
|
|
|


