 |
Орбитальное квантовое число
|
|
|
|
Материал из Википедии — свободной энциклопедии


s-, p- и d-орбитали атома водорода соответствуют орбитальным квантовым числам ℓ = 0, 1, 2.
1, 2 и 3 справа — главные квантовые числа.
Орбитальное квантовое число — в квантовой физике квантовое число ℓ, определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения

Является собственным значением оператора орбитального момента электрона, отличающегося от момента количества движения электрона j лишь на оператор спина s:

Разность орбитального квантового числа и квантового числа полного момента не превосходит, по абсолютной величине,  (спин электрона). Азимутальное квантовое число определяет ориентацию электронного облака в пространстве.
(спин электрона). Азимутальное квантовое число определяет ориентацию электронного облака в пространстве.
20 Магнитное и спиновое квантовые числа
Установлено, что при помещении атома во внешнее магнитное илиэлектрическое поле спектры атомов становятся еще более мультиплётными. С физической точки зрения это означает, что различные электронные облака находящиеся даже на одном подуровне, по разному реагируют на внешнее магнитное поле. Для обозначения этих подподуровней введено третье, магнитное квантовое число тl, принимающее значения всех целых чисел от - l через 0 до + l.
тl = - l,...-2,-1,0,+1.+2,...,+ l
То есть: магнитное квантовое число (тl) показывает реакцию орбит на внешнее магнитное или электрическое поле, зависит, от орбитального квантового числа и обозначается целыми числами от -l до + l.
Электрон помимо движения "вокруг ядра" вращается и вокруг собственной оси. Для обозначения направления этого вращения введено четвёртое квантовое число – cnuнoвoe (ms). Собственный момент вращения - (спин) имеет два значения, условно обозначенные как +1/2 и -1/2.
|
|
|
Упрощенно иногда указывают: по часовой или против часовой стрелки; или изображают в виде стрелки, направленной остриём вверх или вниз.
Следует помнить, что обозначения и числовые значения всем квантовым числам даны условно. Все квантовые числа являются энергетическими характеристиками электрона, т.е. условным образом указывают на различия в энергетическом состоянии электрона. В целях более удобного восприятия мы и придаём квантовым числам определенный физический смысл.
21 Многоэлектронные атомы
имеют целые наборы энергии ионизации. [ 1 ]
Многоэлектронные атомы - В сложных атомах на данный электрон влияет не только ядро, но все остальные электроны. Каждый электрон отталкивается от всех остальных электронов в соответствии с законом Кулона, а потому все волновые функции взаимозависимы. [ 2 ]
Многоэлектронные атомы могут в особых случаях только отдаленно напоминать атом водорода, имея в слое данного квантового числа наборы орбиталей, отличающихся по энергиям, но имеющие недалекие по своему значению гмакс (рис. 2 - 5), а потому и заметно возмущающих друг друга. [ 3 ]
Одноэлектронные и многоэлектронные атомы и ионы. [ 4 ]
Многоэлектронными атомами называются атомы с двумя и более электронами. [ 5 ]
Рассмотриммногоэлектронный атом, в котором у электронов имеются спиновые и орбитальные моменты, и пусть магнитные взаимодействия между магнитными моментами и приложенным магнитным полем малы по сравнению с электростатическими взаимодействиями внутри атома. [ 6 ]
Рассмотриммногоэлектронный атом, заряд ядра которого равен Ze; вокруг ядра движется Z электронов. Электроны будут занимать, в соответствии с запретом Паули, различные орбиты. Еще раз подчеркнем, что слово орбиты не следует понимать слишком буквально. [ 7 ]
|
|
|
Спектрымногоэлектронных атомов возникают при переходах валентных электронов. Атомы с более чем одним валентным электроном имеют несколько систем термов различной мультиплетности. [ 8 ]
Длямногоэлектронных атомов уравнение Шредингера не может быть решено точно; в этом случае используется одноэлектронное приближение, когда движение каждого электрона рассматривается как происходящее в самосогласованном поле ядра и всех остальных электронов. При этом для описания многоэлектронных атомов используются такие же атомные орбитали и тот же набор квантовых чисел, что и для атома водорода. [ 9 ]
Длямногоэлектронных атомов он имеет более сложную форму, однако в наинизшем приближении по параметру перекрытия волновых функций соседних атомов (перекрытие определяет величину обменных интегралов) сводится к гайзенберговскому виду. [ 10 ]
Умногоэлектронных атомов встречаются невозбужденные состояния с нулевыми значениями полного спина и с небольшими значениями магнитного момента, вызванного орбитальным движением электронов. Если и орбитальный момент нулевой, как это имеет место, например, у инертных газов, то вещество диамагнитно. [ 11 ]
Длямногоэлектронного атома nso и Hss содержат члены трех тиров: взаимодействие электронов заполненных оболочек, взаимодействие электронов заполненных оболочек с электронами незаполненных оболочек и взаимодействие электронов незаполненных оболочек. [ 12 ]
Длямногоэлектронных атомов значительно более эффективным оказался метод самосогласованного поля. В этом методе класс варьируемых функций ограничивается только одним условием - искомая функция предполагается построенной из одноэлектронных. Никаких предположений об аналитическом виде искомых функций не делается. Эти функции находятся в результате численного интегрирования системы интегро-дифференциальных уравнений. [ 13 ]
22 Принцип Паули. Электронная структура атомов и периодическая система элементов.
Соответствие принципа Паули эксперименту было подтверждено огромным числом спектроскопических наблюдений, а также многочисленными данными электронной теории металлов, физики ядерных процессов, низкотемпературных явлений. Это один из наиболее фундаментальных объединяющих принципов физики, открывший путь к пониманию электронной структуры сложных атомов. Правда, принципом Паули определяется лишь возможность заполнения различных электронных оболочек, а для проверки фактического заполнения тех или иных состояний необходимы данные, полученные на основе оптических и рентгеновских спектров. Но в атомах вплоть до аргона с Z = 18 каждый дополнительный электрон просто добавляется в низшую из незаполненных подоболочек. Отступления от этого порядка наблюдаются у более сложных атомов, оболочки которых частично перекрываются. Квантовая механика объясняет это отступление тем, что в первую очередь заполняются состояния с самой низкой энергией.
|
|
|
Детальный анализ электронной структуры и распределения электронов с точки зрения квантовой механики и принципа Паули в более тяжелых атомах весьма сложен. Для состояния 1 s (n = 1, l = 0) возможно только сферически симметричное распределение (причем наиболее вероятным оказывается положение электрона в центре атома). В состоянии 2 p (n = 2, l = 1) момент импульса электрона уже не равен нулю, и поэтому масимум плотности находится на ненулевом расстоянии от ядра. Распределение электронной плотности зависит от квантового числа ml в соответствии с требованием квантования компонент момента импульса вдоль направления магнитного поля.
23Энергия ионизации и сродство к электрону.
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями
|
|
|
Наибольшим сродством к электрону обладают p -элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p -орбиталями (N, P, As):
24 Строение атомных ядер. Изотопы.
Атом является сложной системой, в состав которой входят определенные частицы. Английский физик Э. Резерфорд предложил ядерную (планетарную) модель строения атома. Основные положения ядерной модели атома.
1. Атом имеет форму шара, в центре которого находится ядро.
2. Ядро имеет очень маленький размер (диаметр атома 10-10 м, диаметр ядра ~10-15 м).
3. Ядро имеет положительный заряд.
4. Почти вся масса атома находится в ядре.
5. Вокруг ядра движутся электроны.
6. Электроны движутся вокруг ядра, как планеты вокруг Солнца.
Все положения модели Резерфорда, кроме последнего — шестого, современная наука считает правильными. Г. Мозли (Англия) установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе. Положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Менделеева. Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом — это электронейтральная частица, поэтому положительный заряд ядра численно равен сумме отрицательных зарядов всех электронов, или числу электронов (т. к. заряд электрона равен —1) Следовательно: Порядковый номер элемента = Заряд ядра атома = Число протонов в ядре = Число электронов в атоме. Например, элемент железо Fe имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т. е. ядро содержит 26 протонов, а вокруг ядра движутся 26 электронов. Элементарные частицы имеют следующие абсолютные и относительные массы: Масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома. Массовое число атома (A) = Число протонов (Z) + Число нейтронов (N) A=Z+N
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N). Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу — порядковый номер (заряд ядра атома) элемента. Например:12 6C — изотоп углерода с массовым числом 12; Иногда в символах изотопов записывают только массовые числа (12С, 18О, 27Al и т. д.)
|
|
|
Элемент водород имеет три изотопа, каждый из которых имеет свое название: 1 1H 2 1H (D) 3 1Н (Т) протий дейтерий тритий 1протон, нейтронов нет 1 протон, 1 протон, 1 нейтрон 2 нейтрона В названиях изотопов других элементов указываются их массовые числа. Например: 12 6С — углерод-12; В природе различные элементы имеют разное число изотопов с разным процентным содержанием каждого из них. Относительная атомная масса элемента Аr, которая приводится в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изотопа. Например, в природе все атомы хлора представляют собой два вида изотопов: 35Cl (процентное содержание 75,5%) и 37Сl (24,5%). Относительная атомная масса хлора:

25 Радиоактивные элементы и их распад.
Радиоакти́вный распа́д (от лат. radius «луч» и āctīvus «действенный») — спонтанное изменение состава нестабильных атомных ядер (заряда Z, массового числа A) путём испускания элементарных частиц или ядерных фрагментов[1]. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие элементы радиоактивными. Радиоактивными называют также вещества, содержащие радиоактивные ядра.
Установлено, что радиоактивны все химические элементы с порядковым номером, большим 82 (то есть начиная с висмута), и некоторые более лёгкие элементы (прометий итехнеций не имеют стабильных изотопов, а у некоторых элементов, например индия, калияили кальция, одни природные изотопы стабильны, другие же радиоактивны).
Естественная радиоактивность — самопроизвольный распад ядер элементов, встречающихся в природе.
Искусственная радиоактивность — самопроизвольный распад ядер элементов, полученных искусственным путем через соответствующие ядерные реакции.
Энергетические спектры α-частиц и γ-квантов, излучаемых радиоактивными ядрами, прерывистые («дискретные»), а спектр β-частиц — непрерывный.
Распад, сопровождающийся испусканием альфа-частиц, назвали альфа-распадом; распад, сопровождающийся испусканием бета-частиц, был назван бета-распадом (в настоящее время известно, что существуют типы бета-распада без испускания бета-частиц, однако бета-распад всегда сопровождается испусканием нейтрино или антинейтрино). Термин «гамма-распад» применяется редко; испускание ядром гамма-квантов называют обычноизомерным переходом. Гамма-излучение часто сопровождает другие типы распада.
В настоящее время, кроме альфа-, бета- и гамма-распадов, обнаружены распады сэмиссией нейтрона, протона (а также двух протонов), кластерная радиоактивность,спонтанное деление. Электронный захват, позитронный распад (или  -распад), а также двойной бета-распад (и его виды) обычно считаются различными типами бета-распада.
-распад), а также двойной бета-распад (и его виды) обычно считаются различными типами бета-распада.
Некоторые изотопы могут испытывать одновременно два или более видов распада. Например, висмут-212 распадается с вероятностью 64 % в таллий-208 (посредством альфа-распада) и с вероятностью 36 % в полоний-212 (посредством бета-распада).
Образовавшееся в результате радиоактивного распада дочернее ядро иногда оказывается также радиоактивным и через некоторое время тоже распадается. Процесс радиоактивного распада будет происходить до тех пор, пока не появится стабильное, то есть нерадиоактивное ядро, а последовательность возникающих при этом нуклидов называется радиоактивным рядом. В частности, для радиоактивных рядов, начинающихся с урана-238, урана-235 и тория-232, конечными (стабильными) нуклидами являются соответственно свинец-206, свинец-207 и свинец-208.
26Искусственная радиоактивность — весьма распространенное явление: в настоящее время получено по нескольку искусственно-радиоактивных изотопов для каждого из элементов периодической системы. Общее число известных искусственно-радиоактивных изотопов превышает 1500, тогда как естественно-радиоактивных изотопов существует лишь около 40, а число устойчивых (нерадиоактивных) изотопов равно 260.
Все три типа излучений — a, b и g, характерные для естественной радиоактивности,— испускаются также и искусственно-радиоактивными веществами. Однако среди искусственно-радиоактивных веществ часто встречается еще иной тип распада, не свойственный естественно-радиоактивным элементам. Это — распад с испусканием позитронов — частиц, обладающих массой электрона, но несущих -положительный заряд. По абсолютной величине заряды позитрона и электрона равны.
В качестве примера образования позитронно-активного вещества приведем реакцию, открытую Жолио-Кюри:

При облучении алюминия a-частицами испускается нейтрон и образуется изотоп фосфора с массовым числом 30. Естественный фосфор содержит только один изотоп с массовым числом 31. Получаемый по приведенной реакции изотоп фосфора 3015P является радиоактивным и распадается с испусканием позитронов (символ е+) и нейтрино по схеме
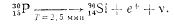
Период полураспада фосфора 3015P равен 2,5 мин; продуктом его распада является устойчивый изотоп кремния 3014Si.
27 Теория химического строения.
|
|
|


