 |
Способы выражения концентрации растворов
|
|
|
|
Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называется концентрацией.
Рассмотрим несколько способов выражения концентрации.
Процентная концентрация (массовая доля растворенного вещества) (ω) показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
 ,
,
где ω – массовая доля (%) растворенного вещества; m1 – масса растворенного вещества, г; m – масса раствора, г.
Масса раствора равна произведению объема раствора V (мл) на его плотность r (г/см3):
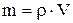 , тогда
, тогда 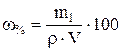 .
.
Молярная концентрация (молярность) раствора – показывает, сколько молей растворенного вещества содержится в 1л раствора.
Молярную концентрацию (моль на литр) выражают формулой
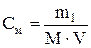 ,
,
где m1 – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; V – объем раствора, л.
Количество вещества в молях определяется по формуле:
n = m1 /М, тогда 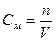
Нормальная концентрация (нормальность раствора) показывает, сколько грамм-эквивалентов растворенного вещества содержится в 1 л раствора (моль на литр): 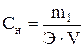 ,
,
где m1 – масса растворенного вещества, г; V – объем раствора, л.
Э – эквивалентная масса растворенного вещества (г/моль), которую рассчитывают по формуле:
Э =  (г/моль),
(г/моль),
где М – мольная масса вещества, n – количество катионов (анионов), В – валентность. Валентность – это способность атомов элемента присоединять определенное число атомов другого элемента. Эквивалент кислоты можно определить по формуле: Э = М (кислоты) / основность (число атомов водорода).
Например: Э Н2SO4= 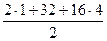 =49г/моль; эквивалент основания по формуле: Э = М (основания) / кислотность (число ОН- групп), так Э Fe(OH)3=
=49г/моль; эквивалент основания по формуле: Э = М (основания) / кислотность (число ОН- групп), так Э Fe(OH)3= 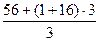 =35,6г/моль; эквивалент соли по формуле: Э = М(соли) / число атомов металла * валентность металла,
=35,6г/моль; эквивалент соли по формуле: Э = М(соли) / число атомов металла * валентность металла,
|
|
|
Э Al2(SO4)3=  =114г/моль.
=114г/моль.
Моляльность раствора Сm показывает количество растворенного вещества, находящееся в 1 кг растворителя:
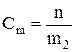 ,
,
где m2 – масса растворителя, кг; n – количество растворенного вещества, моль.
Пример 1. Вычислить молярность и нормальность 40 %-го раствора фосфорной кислоты, плотность которого 1,25 г/см3. Объем раствора 1л.
Решение. Для расчета молярности и нормальности раствора найдем массу фосфорной кислоты в 1 л (1000 мл) 40 %-го раствора:
w = m1 · 100/V ∙ r; 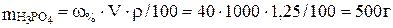 . Молярная масса Н3РO4 равна 98 г/моль, следовательно,
. Молярная масса Н3РO4 равна 98 г/моль, следовательно,  = 500/98 = 5,1 моль/л.
= 500/98 = 5,1 моль/л.
Молярная масса эквивалента Н3РO4 равна 98/3 = 32,7 г/моль.
Тогда СН = 500/32,7 = 1,53 моль/л.
Пример 2. Вычислить массовую долю КОН в 2н. растворе, плотность которого 1,08 г/см3.
Решение. Поскольку нормальность рассчитывается на 1 л раствора, найдем массу растворенного вещества в 1 л:
СН= m1/Э∙V;
ЭKOH = 56 г/моль;
mКОН=2∙56∙1=112 г.
Теперь вычислим массовую доли КОН в растворе, содержащем 112г гидроксида калия:
w= m1∙100/V∙r=112∙100/1000∙1,08=10,4 %.
Пример 3. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1: V2 = С2: С1 или V1∙ С1 = V2 ∙ С2
50С1 = 25 • 0,5; откуда С1 = 25 • 0,5 / 50 = 0,25н.
Задание: решить следующие задачи, принимая объем раствора равным 1 л:
| Вариант | Вещество | Концентрация раствора | Плотность раствора, г/см3 | Вычислить |
| Na2CO3 | 0,30 М | 1,030 | Процентную концентрацию | |
| HNO3 | 9,0 н | 1,275 | Процентную концентрацию | |
| NH4Cl | 10 % | 1,028 | Молярную концентрацию | |
| Al2(SO4)3 | 0,55 М | 1,176 | Процентную концентрацию | |
| HNO3 | 2 м | - | Нормальную концентрацию | |
| HCl | 15,0 % | 1,073 | Нормальную концентрацию | |
| H2SO4 | 13,0 М | 1,680 | Процентную концентрацию | |
| H3PO4 | 44,0 % | 1,285 | Нормальную концентрацию | |
| HClO4 | 9,0 н | 1,150 | Процентную концентрацию | |
| H2SO4 | 2 М | - | Нормальную концентрацию | |
| CH3COOH | 34,0 % | 1,043 | Молярную концентрацию | |
| BaCl2 | 2,30 н | 1,203 | Процентную концентрацию | |
| K2CO3 | 4 М | - | Нормальную концентрацию | |
| CuSO4 | 14,0 % | 1,155 | Нормальную концентрацию | |
| FeCl3 | 1,90 М | - | Нормальную концентрацию | |
| K2CO3 | 6,0 М | 1,567 | Процентную концентрацию | |
| NaCl | 3 н | - | Молярную концентрацию | |
| NaCl | 20 % | 1,148 | Молярную концентрацию | |
| HClO4 | 4,0 н | 1,230 | Процентную концентрацию | |
| K2CO3 | 3 М | - | Нормальную концентрацию |
|
|
|
Задание: решить следующие задачи
| № задачи | |
| На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны молярная концентрация эквивалента и титр раствора H2SO4? Ответ: 0,023 н. | |
| Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна массовая доля полученного раствора: Ответ: 32,5%. | |
| Определить массовую долю сульфата натрия в растворе, полученном при растворении 0,3 моль соли в 150 г воды. | |
| Смешали 100 г 15% и 200 г 30% раствора глюкозы. Определить процентную концентрацию полученного раствора. | |
| Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребуется 50 см3 0,2 н. раствора НС1. Какова молярная концентрация эквивалента раствора AgNO3? Ответ: 0,1 н. | |
| Смешали 247 г 62 %-ного и 145 г 18 %-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,7%. | |
| На нейтрализацию 20 см3 0,2 н. раствора щелочи требуется 40 см3 раствора H2SO4. Чему равна молярная концентрация эквивалента H2SO4? | |
| Смешали 300 г 10% и 500 г 20% раствора хлорида натрия. Определить процентную концентрацию полученного раствора. | |
| На нейтрализацию 60 см3 0,16 н. раствора щелочи требуется 250 см3 раствора H2SO4. Чему равна молярная концентрация эквивалента H2SO4? | |
| Вычислить объем 0,1 н раствора КОН, необходимый для нейтрализации 40 мл 0,18 н раствора азотной кислоты. | |
| Определить массу воды, в которой необходимо растворить навеску хлорида натрия, чтобы получить 200 г 40 % раствора. | |
| Вычислить объем 0,3 н раствора NaОН, необходимый для нейтрализации 60 мл 0,20 н раствора хлороводородной кислоты. | |
| Определить массовую долю сульфата калия в растворе, полученном при растворении 0,2 моль соли в 150 г воды. | |
| Определить массу воды, в которой необходимо растворить навеску сульфата калия, чтобы получить 500 г 10 % раствора. | |
| Вычислить объем 0,2 н раствора NaОН, необходимый для нейтрализации 40 мл 0,35 н раствора азотной кислоты. | |
| Вычислить объем 0,4 н раствора КОН, необходимый для нейтрализации 15 мл 0,3 н раствора азотной кислоты. | |
| Определить массу воды, в которой необходимо растворить навеску сульфата натрия, чтобы получить 200 г 30 % раствора. | |
| Смешали 100 г 10% и 250 г 20% раствора хлорида натрия. Определить процентную концентрацию полученного раствора. | |
| Определить массовую долю нитрата натрия в растворе, полученном при растворении 0,5 моль соли в 200 г воды. | |
| Вычислить объем 0,4 н раствора КОН, необходимый для нейтрализации 20 мл 0,25 н раствора азотной кислоты. |
|
|
|
|
|
|


