 |
Химико-термодинамические расчеты
|
|
|
|
Пример 1. Используя термодинамические величины веществ, вычислить тепловой эффект реакции
Mg3N2 (к) + 6 H2O (ж) «3 Mg(OH)2 (к) + 2 NH3 (г)
Определить, возможна ли эта реакция при стандартных условиях?
Тепловой эффект образования веществ при стандартных условиях найти по данным табл. 1 приложения.
Решение. Находим тепловой эффект DНо реакции по формуле:
∆Н0298=Σ∆Н0298 продуктов - Σ ∆Н0298 исходных веществ
В нашем случае с учетом стехиометрических коэффициентов:
 DНох.р.=[2 (-46,19) + 3 (-924,66)] – [461,1 + 6(-285,840] = -690,22 кДж/моль.
DНох.р.=[2 (-46,19) + 3 (-924,66)] – [461,1 + 6(-285,840] = -690,22 кДж/моль.
Возможность протекания реакции определяют по значению энергии Гиббса. Если ∆G < 0, то реакции протекают самопроизвольно, так как за счет их энергии можно совершить полезную работу. Полезная работа - эта вся работа в ходе процесса, за вычетом работы расширения. Если ∆G > 0, прямая реакция самопроизвольно не протекает. При ∆G ~ 0, наступает химическое равновесие, когда скорость прямой реакции равна скорости обратной реакции.
Для расчета DGo298 воспользуемся уравнением
DGох.р. = DНох.р. – Т DSох.р.
∆S0298=ΣS0298 продуктов - Σ S0298 исходных веществ
DSox.p. =(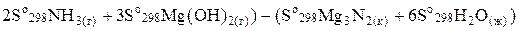
DSox.p =(2×192,5 + 3,63,14) – (87,9 + 6×69,96) = 66,76 Дж/моль∙К.
Теперь находим DGo химической реакции, используя в качестве единой энергетической единицы килоджоуль:
DGox.p. = DHox.p. – T DSox.p.=  кДж/моль.
кДж/моль.
Таким образом, DGox.p. < 0, так что данная реакция термодинамически возможна (протекает слева направо).
Пример 2. Рассчитать тепловой эффект реакции (в кДж/ моль) сгорания этана, если при полном сгорании 1 г этана выделяется 47 кДж.
Решение. Запишем реакцию сгорания этана
С2H6+  O2= 2CO2+3H2O, M (C2H6) = 30 г/моль.
O2= 2CO2+3H2O, M (C2H6) = 30 г/моль.
Если при сгорании 1 г этана выделяется 47кДж, то при сгорании 30 г этана (1 моль) выделиться 30*47 = 1410 кДж. Таким образом, тепловой эффект сгорания этана равен 1410 кДж / моль.
|
|
|
Пример 3. Рассчитать количество теплоты, которое выделилось в результате образования 200 г гидроксида натрия из оксида натрия и воды, если при взаимодействии 10 г оксида натрия с водой выделиться 36,46 кДж.
Решение. Запишем уравнение реакции
Na2O + H2O = 2NaOH
1) Определим, из какого количества оксида натрия образуется 200 г гидроксида
M (NaOH) = 40 г/моль; M (Na2O) = 62 г/моль;
m(Na2O) =  г.
г.
2) Определим количество теплоты, которое выделилось в результате реакции рассчитанного количества Na2O:
10 г Na2O – 36,46 кДж;
155 г Na2O – x кДж;
Х =  кДж.
кДж.
Пример 4. Определить, какое количество теплоты (в кДж) выделилось при сгорании 1 г метана, если при полном сгорании 1 л (н.у.) метана выделилось 40 кДж.
Решение. 1) Один моль любого газа занимает 22,4 л.
Масса 1 л (н. у.) метана m(CH4)=  г.
г.
2) Определим количество теплоты, которое выделилось при сгорании 1 г метана
0,71 г CH4 – 40 кДж;
1г CH4- x;
Х=  кДж.
кДж.
Задание. Используя термодинамические величины веществ, вычислить тепловой эффект реакции. Определить, возможна ли эта реакция при стандартных условиях?
Тепловой эффект образования веществ при стандартных условиях найти по данным таблицы «Термодинамические константы некоторых веществ» в табл. 1 приложения.
| № задачи | Уравнение реакции |
| Ве2С(к) + 4 Н2О (ж) «2 Ва(ОН)2 (к) + СН4 (г) | |
| CaO (к) + 3 С (к) ® СаС2 (к) + СО (г) | |
| Fe2O3 (к) + 2 LiOH (к) «2 LiFeO2 (к)+ H2O (ж) | |
| 4 Al(OH)3 (к) + 3 CH4 (г) «Al4C3 (к) + 12 H2O (ж) | |
| 3 SiH4 (г) + 4 NH3 (г) «Si3N4 (к) + 12 H2 (г) | |
| TiCl4 (ж) + 2 Mg (к) «Ti (к) + 2 MgCl2 (к) | |
| 3 MgO (к) + 2 Al (к) «3 Mg (к) + Al2O3 (к) | |
| 2 Сu2O (к) + Cu2S (к) «6 Cu (к) + SO2 (г) | |
| CaSO4 (к) + CO2 (г) «CaCO3 (к) + SO3 (г) | |
| 4 HCl (г) + O2 (г) «2Cl2 (г) + 2 H2O (ж) | |
| Li3N (к) + 3 Н2 (г) «3 LiН (к) + NН3 (г) | |
| GeO2 (к) + 4 HCl (г) «GeCl4 (г) + 2 H2O (г) | |
| V2O5 (к) + 5 Fe (к) «2 V (к) + 5 FeO (к) | |
| SiCl4 (г) + 2 H2 (г) «Si (к) + 4 HCl (г) | |
| Li2O (к) + 3 C (гр.) «Li2C2 (к) + CO (г) | |
| CaCO3 (к) + 4 С (гр.) «СaС2 (к) + 3 CO (г) | |
| Fe2O3 (к) + CO (г) «2 FeO (к) + CO2 (г) | |
| WO3 (к) + 3 H2 (г) «W (к) + 3 H2O (г) | |
| SO2 (г) + 2 H2S (г)® 3 S (к) + 2 H2O (ж) | |
| Na2CO3 (к) + SiO2(к) ® Na2SiO3(к)+ CO2 (г) |
|
|
|
Задание: решить следующие задачи
| № задачи | |
| Найти количество затраченного тепла при образовании 10 моль кислорода по реакции КClО4 ↔ КCl + 2О2 , Δ Н=33 кДж. | |
| Найти количество выделяемого тепла при получении 2 моль этанола по термохимическому уравнению С2H4(г) + H2O(ж) ↔ C2H5OH(ж), ∆H= -44 кДж. | |
| Сколько литров (н.у.) метана необходимо сжечь для получения 500 кДж теплоты в соответствии с термохимическим уравнением реакции CH4(г)+2O2(г) ↔ CO2(г)+2H2O(г), ∆H =-802 кДж. | |
| Сколько необходимо затратить тепла для получения 560 г железа по уравнению FeO + H2 ↔ Fe + H2О, ∆H =23 кДж. | |
| Определить, какое количество теплоты (в кДж) выделилось при сгорании 4 г метана, если при полном сгорании 1 л (н.у.) метана выделилось 40 кДж. | |
| Рассчитать количество теплоты, которое выделилось в результате образования 500 г гидроксида натрия из оксида натрия и воды, если при взаимодействии 10 г оксида натрия с водой выделиться 36,46 кДж. | |
| Найти количество затраченного тепла при образовании 5 моль кислорода по реакции КClО4 ↔ КCl + 2О2 , Δ Н=33 кДж. | |
| Найти количество выделяемого тепла при получении 7 моль этанола по термохимическому уравнению С2H4(г) + H2O(ж) ↔C2H5OH(ж), ∆H= -44 кДж. | |
| Сколько литров (н.у.) метана необходимо сжечь для получения 200 кДж теплоты в соответствии с термохимическим уравнением реакции CH4(г)+2O2(г) ↔CO2(г)+2H2O(г), ∆H =-802 кДж. | |
| Определить, какое количество теплоты (в кДж) выделилось при сгорании 10 г метана, если при полном сгорании 1 л (н.у.) метана выделилось 40 кДж. | |
| Сколько необходимо затратить тепла для получения 1020 г железа по уравнению FeO + H2 ↔ Fe + H2О, ∆H =23 кДж. | |
| Найти количество выделяемого тепла при образовании 2 моль Na2SiO3 по реакции Na2O (к) + SiO2 (к) «Na2SiO3 (к), Δ Н=-243,5 кДж | |
| Найти количество затраченного тепла при получении 2 моль NO по термохимическому уравнению N2(r) + О2(г) «2NO(r), ∆H= + 180,5 кДж. | |
| Найти количество затраченного тепла при получении 2 моль С по термохимическому уравнению СН4 = Сгр + 2Н2, ∆H= + 74,9 кДж. | |
| Найти количество затраченного тепла при получении 10 моль NO по термохимическому уравнению N2(r) + О2(г) «2NO(r), ∆H= + 180,5 кДж. | |
| Сколько литров (н.у.) кислорода необходимо для получения 250 кДж теплоты в соответствии с уравнением реакции CH4(г)+2O2(г) ↔ CO2(г)+2H2O(г), ∆H =-802 кДж. | |
| Найти количество затраченного тепла при получении 10 моль СO по термохимическому уравнению CaO (к) + 3 С (к) «СаС2 (к) + СО (г), ∆H= + 466,0кДж. | |
| Найти количество выделяемого тепла при получении 2 моль Са3(РО4)2 по термохимическому уравнению 3 СаО (к) + Р2О5 (к) «Са3(РО4)2 (к), ∆H= - 739,0 кДж. | |
| Сколько литров (н.у.) кислорода необходимо для получения 150 кДж теплоты в соответствии с уравнением реакции CH4(г)+2O2(г) ↔ CO2(г)+2H2O(г), ∆H =-802 кДж. | |
| Сколько литров (н.у.) метана необходимо для получения 1000 кДж теплоты в соответствии с уравнением реакции CH4(г)+2O2(г) ↔ CO2(г)+2H2O(г), ∆H =-802 кДж. |
9. Скорость химических реакцийи равновесие
|
|
|
Пример 1. Как изменится скорость реакции 4Al + 3О2 ↔ 2Al2О3 при увеличении давления в 2 раза.
Решение. Поскольку давление влияет только на газообразные вещества  ,
,
где V– скорость реакции; k – коэффициент пропорциональности, называемый константой скорости химической реакции.
Таким образом, скорость прямой реакции увеличится в 23 = 8 раз. А скорость обратной реакции по формальным признакам не зависит от давления, так как исходным реагентом для обратной реакции является твердое вещество.
Пример 2. Температурный коэффициент скорости реакции равен 3. Во сколько раз возрастает скорость реакции при повышении температуры от 280 до 300 °С?
Решение. Простейшая зависимость скорости реакции от температуры выражаетсяэмпирическим правилом Вант-Гоффа:
Vt+Dt / Vt= γDt/10,
где Vt+Dt / Vt – изменение скорости реакции; γ- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2-4.
Vt+Dt / Vt= 3300-280/10 = 32 = 9
При повышении температуры на 20 0C скорость реакции увеличится в 9 раз.
Пример 3. В системе А(г) + 2 В(г) = С(г) равновесные концентрации равны: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением
|
|
|
 .
.
Подставляя в него данные задачи, получаем
 .
.
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции из 1 моля А и 2 молей В образуется I моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216×2=0,432 моля В. Таким образом, исходные концентрации равны:
[A0] = 0,06 + 0,216 = 0,276 моль/л,
[Во] = 0,12 + 0,432 = 0,552 моль/л.
Пример 4. Каким образом нужно изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие реакции в сторону прямой реакции - разложения РС15?
РС15(г) ↔ РС13(г) + С12(г); DН = +92,59 кДж.
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) Повышение температуры смещает равновесие в сторону эндотермической реакции (∆Н > 0), а понижение - в сторону экзотермической (∆Н < 0). Так как реакция разложения РС15 эндотермическая ( DН > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвует хотя бы одно газообразное вещество и число моль исходных газообразных веществ и газообразных продуктов реакции не одинаково. При уменьшении или увеличении давления равновесие смешается соответственно в сторону образования большего или меньшего числа моль газа. Так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) Если внешнее воздействие на систему проявляется в уменьшении концентрации одного из веществ, участвующих в реакции, то это смещает равновесие в сторону его образования. При увеличении концентрации одного из веществ равновесие системы смещается в сторону той реакции, которая ее уменьшает. Поэтому смешения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или С12.
Задание: определить, как изменится скорость прямой реакции при изменении условий
| № задачи | Уравнение реакции | Условие |
| А(г) + 2 В(г) = С(г) | Повышение давления в 2 раза | |
| А(г) + В(г) = С(г) + D(тв) | Повышение концентрации вещества А(г) в 3 раза | |
| А(г) + В(г) = 2С(г) + D(тв) | Повышение давления в 4 раза | |
| А(г) + В(тв) = С(г) + D(тв) | Повышение давления в 4 раза | |
| 3А(тв) + В(г) = 2С(г) + D(г) | Повышение концентрации вещества В(г) в 2 раза | |
| А(ж) + В(г) = С(г) + D(ж) | Повышение концентрации вещества А(ж) в 3 раза | |
| А(г) + В(г) = С(ж) + D(тв) | Повышение давления в 3 раза | |
| А(г) + 2 В(г) = С(г) | Повышение концентрации вещества В(г) в 2 раза | |
| А(ж) + В(тв) = С(тв) + D(ж) | Повышение давления в 3 раза | |
| А(тв) = С(г) + D(г) | Повышение давления в 3 раза | |
| 2А(тв) + В(г) = 3С(г) | Повышение концентрации вещества А в 3 раза | |
| А(ж) + 2 В(ж) = С(ж) + D(ж) | Повышение давления в 3 раза | |
| 2А(г) + 3В(ж) = 3С(г) + 3D(тв) | Повышение концентрации вещества В(ж) в 2 раза | |
| А(г) + 2В(г) = 3С(г) + D(тв) | Повышение концентрации вещества А в 10 раз | |
| А(г) + В(ж) = С(г) + D(тв) | Повышение давления в 5 раз | |
| А(г) + 2 В(г) = 3С(г) | Повышение давления в 5 раз | |
| А(г) + В(г) = С(г) + D(тв) | Повышение концентрации вещества А в 3 раза | |
| 2А(г) + 2 В(г) = С(г) + D(тв) | Повышение давления в 3 раза | |
| А(г) + 2 В(г) = С(г) + D(ж) | Повышение давления в 3 раза | |
| 3А(г) + 2 В(г) = 2С(г) | Повышение концентрации вещества А в 10 раз |
|
|
|
Задание: вычислить показатель, отмеченный знаком «?», используя имеющиеся данные:
| № задачи | Начальная температура, 0С | Конечная температура, 0С | Температурный коэффициент, γ | Изменение скорости химической реакции |
| ? | 3,00 | Увеличилась в 9 раз | ||
| ? | Увеличилась в 27 раз | |||
| ? | 3,00 | Уменьшилась в 9 раз | ||
| 2,00 | ? | |||
| ? | Уменьшилась в 27 раз | |||
| 2,50 | ? | |||
| 2,80 | ? | |||
| 2,30 | ? | |||
| ? | Увеличилась в 9 раз | |||
| ? | 3,00 | Уменьшилась в 9 раз | ||
| ? | Увеличилась в 8 раз | |||
| ? | 2,00 | Увеличилась в 4 раза | ||
| ? | 2,00 | Уменьшилась в 16 раз | ||
| 2,60 | ? | |||
| 2,40 | ? | |||
| ? | 3,50 | Увеличилась в 3,5 раза | ||
| ? | Уменьшилась в 8 раз | |||
| 2,00 | ? | |||
| 3,00 | ? | |||
| ? | 3,00 | Увеличилась в 81 раз |
Задание: вычислить константу равновесия химической реакции и определить исходные концентрации вступивших в реакцию веществ
| № задачи | Уравнение реакции | Равновесные концентрации См, моль/л |
| Cl2 + CO «COCl2 | См: Cl2=2.5; CO=1.8; COCl2=3.2 | |
| 2NO2«2NO + O2 | См: NO2=0.02; NO=0.08; O2=0.16 | |
| 2SO2 + O2 «2SO3 | См: SO2=0.02; O2=0.4; SO3=0.3 | |
| N2 + 3H2 «2NH3 | См: N2=2.5; H2=1.8; NH3=3.6 | |
| 2NO + O2 «2NO2 | См: NO=0.056; O2=0.028; NO2=0.044 | |
| 2N2 + O2 «2N2O | См: N2=0.072; O2=1.12; N2O=0.84 | |
| H2 + I2 «2HI | См: H2=0.025; I2=0.005; HI=0.009 | |
| N2 + 3H2 «2NH3 | См: N2=3; H2=9; NH3=4 | |
| A + B «C | См: A=0.06; B=0.12; C=0.216 | |
| 3 A + B ↔ 2 C | См: A=0.03; B=0.01; C=0.08 | |
| 2 NO2 ↔ 2 NO + O2 | См: NO2 =0,006; NO =0,024; O2=0,012 | |
| CO + Cl2 ↔ COCl2 | См: Cl2 =0,3; CO = 0,2; COCl2=1,2 | |
| 2 SO2 + O2↔ 2SO3 | См: SO2 =0,04; O2=0,06; 2SO3=0,02 | |
| N2 + 3H2 ↔ 2NH3 | См: NH3 = 0,4; N2 = 0,03; H2 = 0,1 | |
| 2 NO2 ↔ 2 NO + O2 | См: NO2 =0,006; NO =0,024; O2=0,012 | |
| 3 A + B ↔ 2 C | См: A=0.03; B=0.01; C=0.08 | |
| H2 + I2 «2HI | См: H2=0.025; I2=0.005; HI=0.009 | |
| 2NO + O2 «2NO2 | См: NO=0.056; O2=0.028; NO2=0.044 | |
| 2SO2 + O2 «2SO3 | См: SO2=0.02; O2=0.4; SO3=0.3 | |
| CO + Cl2 ↔ COCl2 | См: Cl2 =0,3; CO = 0,2; COCl2=1,2 |
Задание: Каким образом нужно изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие реакции в сторону прямой реакции?
| № задачи | Уравнение реакции | D Н реакции, кДж |
| MgCO3 (к) «MgO (к) + CO2 (г) | + 101,7 | |
| CS2 (ж) + 3 О2 (г) «СО2 (г) + 2 SO2 (г) | - 1075,0 | |
| 3 СаО (к) + Р2О5 (к) «Са3(РО4)2 (к) | - 739,0 | |
| 2 РH3 (г) + 4 О2 (г) «Р2О5 (к) + 3 Н2О (ж) | -2360,4 | |
| СН3ОН(ж) + 3/2 О2 (г) «СО2 (г) + 2 Н2О (ж) | - 726,78 | |
| SO2 (г) + 2 H2S (г) «3 S (к) + 2 H2O (ж) | - 234,5 | |
| Na2CO3 (к) + SiO2(к) «Na2SiO3(к)+ CO2 (г) | + 819,3 | |
| CaO (к) + 3 С (к) «СаС2 (к) + СО (г) | + 466,0 | |
| Hg(ONC)2 (к) «Hg (г) + 2 CO (г) N2(г) | + 364,2 | |
| Na2O (к) + SiO2 (к) «Na2SiO3 (к) | - 243,5 | |
| N2(r) + О2(г) «2NO(r) | + 180,5 | |
| С2Н2(Г) + 2,5 О2(Г) «Н2О(Г) + 2СО2(Г) | - 130 | |
| 2NaOH + H2SO4 «Na2 SO4 + 2H2O | - 131,4 | |
| NaOH + H2SO4 «NaHSO4 + H2O | - 61,7 | |
| NaHSO4 + NaOH «Na2SO4 +H2O | - 69,7 | |
| Fe2O3 + 2A1 «А12О3 + 2Fe | -853,8 | |
| СН4 = Сгр + 2Н2 | + 74,9 | |
| Сгр+О2 = СО2 | - 393,5 | |
| SiCl4 (г) + 2 H2 (г) «Si (к) + 4 HCl (г) | + 295,2 | |
| Mg3N2 (к) + 6 H2O (ж) «3 Mg(OH)2 (к) + 2 NH3 (г) | -690,22 |
|
|
|


