 |
Молекулярно-ионные уравнения обменных реакций
|
|
|
|
Между растворами электролитов
Обменные реакции между электролитами практически необратимы и идут до конца в случае образования малорастворимых, малодиссоциирующих и газообразных соединений. При составлении молекулярно-ионных уравнений реакций малорастворимые, малодиссоциирующие, газообразные вещества и неэлектролиты записывают в виде молекул, а сильные электролиты в виде ионов, на которые они диссоциируют.
Иногда встречаются и такие процессы, при которых труднорастворимые соединения находятся как среди исходных, так и конечных продуктов реакции:
BaCO3↓ + K2SO4 ↔ BaSO4 ↓ + K2CO3.
В подобных реакциях равновесие смещается в сторону образования того вещества, которое менее растворимо. Так как ВаСО3 более растворим (8,95·10-5 г-экв/л), чем BaSO4 (9,34·10-6 г-экв/л), то равновесие смещено слева направо.
Пример 1. Напишите в молекулярной и ионно-молекулярной формах реакции взаимодействия между следующими веществами:
a) BaCI2 и Nа2SO4; б) Na2SO3 и НCl; в) K2CO3 и НNО3
Решение. Сильными электролитами являются почти все растворимые соли (кроме СиС12, Рb(СН3СОО)2, Fe(CNS)3), щелочи и сильные кислоты (HCI, НВг, НI, НNO3, Н2SO4, НClO4, НМnO4). В работе используем табл. 2 «Растворимость солей и оснований в воде» приложения.
a) BaCI2 +Na2SO4 = BaSO4¯ + 2 NaCI
Ва2++ 2Сl– + 2Na+ + SO42– = BaSO4¯ + 2Na+ + 2Сl–
Ba2+ + SO42– = BaSO4¯
б) Na2SO3 + 2 HCI = 2NaCI + H2SO3
2Na+ + SO32- + 2 H+ + 2Сl– = 2Na+ + 2Сl– + H2SO3
2 H+ + SO32– = H2SO3
в) К2СO3 + 2 HNO3 = Н2O + СO2 + 2 KNO3
2 К+ + СО32– + 2 Н+ + 2NO3– = Н2O + СО2 + 2 К+ + 2NO3–
2 Н+ + СО32– = Н2O + СO2
Задание: напишите в молекулярной и молекулярно-ионной форме уравнения реакций взаимодействия следующих веществ:
| № задачи | Взаимодействующие вещества | ||
| А | б | в | |
| Nа2S + FeSO4 Nа2S + HCI CH3COONa + HNO3 H2SO4 + КОН Рb(NO3)2 + NaI Ba(NO3)2+Na2SO4 Nа2СO3 +Н2SO4 KCN + HNO3 CuSO4 + NaOH Na2SO3 + H2SO4 AgNO3 + KCI Cu(OH)2 + HCI AgNO3 + FeCI3 BaCl2 + Na2SO4 NiCl2 + H2S Ba(OH)2 + HCl CH3COOH + NH4OH AgNO3 + NaCl NH4OH + HCl CaCO3 + HCl | СаСO3 + HCI Ва(ОН)2 + HNО3 SrSO4 + BaCI2 NH4С1 + Са(ОН)2 NH4CI + КОН Sr(ОH)2+НС1 НзРO4 +Ca(NO3)2 NH4ОН + HCI CH3COOK + K2SO4 FeCI3 +NaOH NH4CI + NaOH СuС12 + Са(ОН)2 K2SO3 + HCI Na2SO3 + HCI Pb(NO3)2 + KI HF + KOH HNO2 + NH4OH Na2SO3 + H2SO4 Ca(OH)2 + HCl Na2SiO3 + HCl | Sn(OH)2 + NaOH Zn(OH)2 + КОН AI(OH)3 + LiOH Zn(NO3)2+КОН(изб.) AICI3 + NаОН(изб.) Cr(ОН)3 +RbOH CrCI3 + LiОН(изб.) Ве(ОH)2 + NаОН Sn(OH)4 + КОН Cr(NO3)3+КОН(изб.) Аl(NO3)3+RbОН(изб.) Sn(OH)2 + Ba(OH)2 Zn(OH)2 + Sr(OH)2 K2CO3 + HNO3 K2CO3 + HCl Fe(OH)3 + HNO3 H2S + NH4OH Zn(OH)2 + H2SO4 Ba(OH)2 + HNO3 NaNO3 + KCl |
|
|
|
Гидролиз солей
Сущность реакций гидролиза состоит во взаимодействии ионов соли с ионами водыс образованием слабых электролитов. В процессе гидролиза один из ионов воды связывается в слабый электролит, а другой, как правило, накапливается в растворе. Тот ион, который накапливается в растворе, определяет реакцию среды. Если накапливаются ионы Н+, то среда будет кислой, если группы ОН- – щелочной. При образовании одинаковых по силе электролитов среда может быть и нейтральной.
Уравнения гидролиза пишутся аналогично другим ионным уравнениям: малодиссоциированные (в том числе и вода) и малорастворимые, а также газообразные вещества пишутся в виде молекул, сильные электролиты записываются в виде ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням, аналогично ступенчатой диссоциации.
Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли – катион, анион или оба вместе, способны образовывать с ионами воды Н+ и ОН– – малодиссоциированные сочетания. Гидролизу подвергаются соли, образованные: слабыми кислотами и сильными основаниями; слабыми основаниями и сильными кислотами; слабыми кислотами и слабыми основаниями.
|
|
|
Пример 1. Какие из перечисленных ниже солей подвергаются гидролизу: NH4I, Na2S, Al(CH3COO)3, CaCl2?
Решение. Иодид аммония - соль, образованная сильной кислотой и слабым основанием. Гидролизу подвергается катион соли. Реакция раствора кислая: рН<7.
NH4I + HOH «NH4OH + HI.
Или в ионном виде:
NH4+ + HOH «NH4OH + H+.
Сульфид натрия – соль, образованная сильным основанием и слабой кислотой.
При растворении солей многоосновных кислот гидролиз протекает ступенчато:
Na2S + H2O «NaHS + NaOH.
Или в ионной форме:
S2– + H2O «HS– + OH–.
Гидролизу подвергается анион соли. Процесс отражает гидролиз по первой стадии.
Чтобы гидролиз соли многоосновной кислоты прошел полностью, как правило, увеличивают температуру процесса:
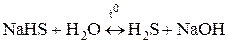 ,
,
или в ионной форме: 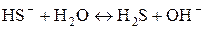 .
.
Раствор такой соли проявляет щелочную реакцию рН>7.
Ацетат алюминия – соль, образованная слабым основанием и слабой кислотой. Гидролизу подвергается как катион, так и анион соли:
Al(CH3COO)3 + H2O «AlOH(CH3COO)2 + CH3COOH.
Параллельно идут два процесса:
Al3+ + H2O «AlOH2+ + H+,
CH3COO– + H2O «CH3COOH + OH–.
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль и примерно = 7.
Хлорид кальция - соль, образованная сильным основанием и сильной кислотой. Взаимодействие с водой можно представить таким образом:
CaCl2 + 2H2O «Ca(OH)2 + 2HCl,
H2O «H+ + OH–.
Однако единственным малодиссоциирующим соединением в реакции остается сама вода, следовательно, равновесие реакции полностью смещено влево - гидролиз не идет. Раствор соли проявляет нейтральную среду.
Задание: Указать, какие из перечисленных ниже солей подвергаются гидролизу. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнения гидролиза, указать реакцию водного раствора соли.
| № задачи | |
| CrCI3, Na2S, AI2S3, KNO3 Zn(NO3)2, NaNO2, Ba(NO3)2, (NH4)2S MnSO4, CH3COONH4, KCI, NaHSO3 Na2SiO3, CuSO4, NaBr, Pb(CH3COO)2 NaH2PO4, AI2(SO4)3, NH4CN, BaCI2 Ca(HS2), Fe(CN)2, Ni(NO3)2, NaCI HCOONH4, FeCI3, KHCO3, Li2SO4 (CuOH)2SO4, (NH4)2CO3, K2SO4, Ba(NO3)2 Cr2(SO4)3, K2S, Na2SO4, Cr2S3 Na3AsO4, CoSO4, NaCIO4, Al2S3 CsNO3, K2HAsO4, NH4CIO4, Cu(CH3COO)2 Na2TeO3, ZnSO4, KJ, Fe(HCOO)3 K2HAsO4, NH4Br, RbNO3, Al(CH3COO)3 CaS, SrCl2, MgSO4, (NH4)2SO3 K2Se, BaJ2, Pb(CH3COO)2, SnSO4 NH4CN, Mg(ClO4)2, Ca(HS)2, RbCl Ca(NO2)2, Li2CrO4, Cr2S3, Zn(NO3)2 (ZnOH)2SO4, NaAsO2, Fe(CN)2, K2SO4 Zn(CN)2, Li2SO3, MnSO4, (NH4)2CO3 Bi(NO3)2, Li2SiO3, KJ, (NH4)2CO3 SbCl3, K2CrO4, Zn(CN)2, CdSO4 CH3COOK, Fe2(SO4)3, BaCl2, Al2S3 Al2S3, CsNO3, NH4ClO4, K2Te K2Te, SnSO4, Cu(CN)2, NaNO3 NaBr, Cu(CH3COO)2, SrS, FeCl3 K2CO3, NaNO2, NH4HCOO, LiCl NaClO3, (NH4)2SO4, CH3COOK, KNO3 CuCl2, Ca(CH3COO)2, Pb(NO3)2, NaBr FeCl3, (NH4)2CO3, Na3PO4, K2CrO4 |
|
|
|
|
|
|


