 |
Окислительно - восстановительные реакции (ОВР)
|
|
|
|
УРОВЕНЬ В
Уравнять реакцию. Указать окислитель и восстановитель.
KCrO2 + Br2 + KOH → KBr + K2Cr2O7 + H2O
Определить массу KCrO2, необходимую для взаимодействия с
Г брома.

| РЕШЕНИЕ: |
КCr+3O2 + Br20 + KOH = KBr  + K2Cr2+6O7 + H2O
+ K2Cr2+6O7 + H2O
восст. окисл. среда
 НОК ДМ
НОК ДМ
 окисл-ль Br20 + 2ē = 2Br - 3
окисл-ль Br20 + 2ē = 2Br - 3
 восст-ль Cr+3 - 3ē = Cr+6 2
восст-ль Cr+3 - 3ē = Cr+6 2
3Br20 + 2Cr+3 = 6Br  + 2Cr+6
+ 2Cr+6
2KCrO2 + 3Br2 + 6KOH → 6KBr + K2Cr2O7 + 3H2O
Согласно уравнению реакции 2 моль KCrO2 реагирует с 3 моль Br2, т.е.
2М  – 3М
– 3М  2·123 г/моль - 3·160 г/моль
2·123 г/моль - 3·160 г/моль
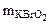 -
- 
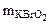 - 4 г.
- 4 г.
 =
=  = 2,05 г
= 2,05 г
Ответ: окислитель – Br2, восстановитель – KCrO2,  = 2,05г.
= 2,05г.
2. Уравнять реакцию. Указать окислитель и восстановитель:
H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Определить cэк(Н2S), если на взаимодействие с 3,16 г KMnO4 израсходовано 200 см3 раствора H2S.
Дано:
 3,16 г 3,16 г
 = 200 см3 = 200 см3
|
Уравнять реакцию, указать окислитель и восстановитель, определить 
|
РЕШЕНИЕ:
H2S-2 + KMn+7O4 + H2SO4 = S0 + Mn+2SO4 + K2SO4 + H2O
восст. окисл. cреда
НОК ДМ

 восст-ль S-2 - 2ē = S0 5
восст-ль S-2 - 2ē = S0 5
окисл-ль Mn+7 + 5ē = Mn+2 2

5S-2 + 2Mn+7 = 5S0 + 2Mn+2
Переносим полученные коэффициенты в молекулярное уравнение:
5H2S + 2KMnO4 + H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O
Подсчитываем количество H2SO4 необходимое для получения 2 моль MnSO4 и 1 моль K2SO4. Для этого необходимо 3 моль H2SO4:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O
Уравниваем количество водорода и кислорода (8Н2О):
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
По закону эквивалентов nэк(H2S) = nэк(KMnO4)

 =
=  , г/моль
, г/моль
где  - число электронов, принятых одной молекулой KMnO4.
- число электронов, принятых одной молекулой KMnO4.
 =
= 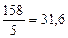 г/моль
г/моль
 ·0,2 =
·0,2 =  = 0,1
= 0,1
 =
=  = 0,5 моль/л
= 0,5 моль/л
Ответ: окислитель - KMnO4, восстановитель - Н2S, 
3. Определить направление протекания реакции:
а) KI-1 + Cu+2Cl2 <=> Cu+Cl + KCl + I20
б) KI-1 + Fe+3Cl3 <=> Fe+2Cl2 + KCl + I20
Расставить коэффициенты, указать окислитель и восстановитель.
|
|
|
Вычислить константу равновесия реакции при стандартных условиях.
| Дано: Уравнение реакции |
| Уравнять реакцию и указать окислитель и восстановитель. Определить направление протекания реакции. Кс -? |
РЕШЕНИЕ:
а) Для того, чтобы определить направление протекания окислительно-восстановительной реакции, надо сопоставить силу окислителей для следующих полуреакций (см. таблицу)
Cu2+ + e- = Cu+ φ 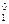 = +0,15 B
= +0,15 B
I2 + 2e- = 2I- φ  = +0,54 B
= +0,54 B
Из двух приведенных окислителей более сильным окислителем будет I2, поскольку φ  > φ
> φ 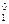 .
.
I2 находится в продуктах реакции, следовательно, реакция будет протекать справа налево т.е. реально протекающей будет реакция:
CuCl + KCl + I2 <=> KI + CuCl2
Расставляем коэффициенты методом электронного баланса:
Cu+1Cl + KCl + I20 = Cu+2Cl2 + KI-1

 НОК ДМ
НОК ДМ
Cu+1 - e- = Cu+2 2
 I
I  + 2e- = 2I-1 1
+ 2e- = 2I-1 1
I20 + 2Cu+1 = 2Cu+2 + 2I 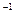
2CuCl + 2KCl + I2 <=> 2KI + 2CuCl2
ΔrG0(298K) = -z·F·ε˚ (9.1)
где z - число отданных или принятых электронов (НОК = 2);
F = 96500 Кл/моль; ε˚ - стандартное напряжение ОВР, В
ε˚ = φ˚ок - φ˚восст (9.2)
ε˚ =  = 0,54-0,15 = 0,39В
= 0,54-0,15 = 0,39В
ΔrG0(298K) = -2·96500·0,39 = -75270 Дж,
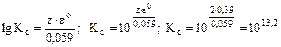 = 1,66·1013.
= 1,66·1013.
Ответ: окислитель - I2; восстановитель – CuCl, приведенная в условии задачи реакция (а) протекает справа налево, КС =1,66·1013.
б) Из таблицы определяем стандартные электродные потенциалы окислителей для реакции
KI + FeCl3 <=> FeCl2 + KCl + I2
Fe3+ + e- = Fe+2 φ  = +0,77 B
= +0,77 B
I2 - 2e- = 2I- φ  = +0,54 B
= +0,54 B
Из двух приведенных окислителей более сильным окислителем будет Fe+3, поскольку φ 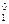 > φ
> φ  .
.
Fe+3 находится в исходных веществах, следовательно, реакция будет протекать слева направо т.е. реально протекающей будет реакция (б), приведенная в условии задачи:
KI + FeCl3 <=> FeCl2 + KCl + I2
Расставляем коэффициенты методом электронного баланса:
KI-1 + Fe+3Cl3 = Fe+2Cl2 + KCl + I20
НОК ДМ



 I-1 - e- = I0 1 2
I-1 - e- = I0 1 2
1 2
Fe+3 + e- = Fe+2 1 2
 I-1 + Fe+3 = Fe+2 + I0
I-1 + Fe+3 = Fe+2 + I0
Поскольку после реакции образуется четное число атомов иода, значения НОК и ДМ удваиваем.
2KI + 2FeCl3 <=> 2FeCl2 + 2KCl + I2
|
|
|
ΔrG0(298K) = -z·F·ε˚ (9.1)
где z - число отданных или принятых электронов (НОК = 2);
F = 96500 Кл/моль; ε˚ - стандартное напряжение ОВР, В
ε˚ = φ˚ок - φ˚восст (9.2)
ε˚ = 0,77-0,54 = 0,23В
ΔrG0(298K) = -2·96500·0,23 = -44390 Дж,
 = 6,3·107.
= 6,3·107.
Ответ: окислитель – FeCl3; восстановитель – KI, реакция протекает слева направа, Кс =6,3·107.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
КОРРОЗИЯ МЕТАЛЛОВ.
УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10-3М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

| РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
 = - 0,76 В,
= - 0,76 В,  = - 0,74В.
= - 0,74В.
Хлорид цинка диссоциирует по уравнению:
ZnCl2 = Zn2+ + 2Сl-.
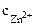 =
= 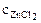 ∙α∙
∙α∙  = 1∙1∙1 = 1 моль/л,
= 1∙1∙1 = 1 моль/л,
α = 1 (ZnCl2 – сильный электролит),  = 1, поскольку условия стандартные
= 1, поскольку условия стандартные  = -0,76В.
= -0,76В.
Хлорид хрома (III) диссоциирует по уравнению:
CrCl3 = Cr3+ + 3Сl-
 =
= 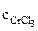 ∙α∙
∙α∙  = 10-3∙1∙1 = 10-3 моль/л,
= 10-3∙1∙1 = 10-3 моль/л,
α = 1 (CrCl3 – сильный электролит),  = 1, поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
= 1, поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
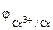 =
=  +
+  = -0,74 +
= -0,74 +  lg10-3= -0,80В
lg10-3= -0,80В
Так как 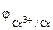 <
< 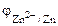 , то в ГЭ анодом будет являться хром, катодом – цинк.
, то в ГЭ анодом будет являться хром, катодом – цинк.
Составляем схему ГЭ:
А (-) Cr │ CrCl3 ││ ZnCl2 │ Zn (+) K
А (-) Cr │ Cr3+ ││ Zn2+ │ Zn (+) K
Составляем уравнения электродных процессов и суммарной токообразующей реакции:

 НОК ДМ
НОК ДМ
На A(-)Cr – 3ē = Cr3+ 2
На К(+)Zn2+ + 2ē = Zn 3

2Cr + 3Zn2+ = 2Cr3+ + 3Zn - суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn - суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
 =
= 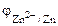 -
-  = -0,76-(-0,80)= 0,04В
= -0,76-(-0,80)= 0,04В
Ответ: ε = 0,04В.
2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni2+ = Fe2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG0(298К, Men+) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
∆fG0 (298 К, Ni2+) = - 64,4 кДж/моль;
|
|
|
∆fG0 (298 К, Fe2+) = - 84,94 кДж/моль.
Дано:
ΔfG0(298K, Ni2+) = -64,4 кДж/моль
ΔfG0(298K, Fe2+) = -84,94 кДж/моль
Т = 298 К
 ε0 -? Кс -?
ε0 -? Кс -?
| РЕШЕНИЕ: На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов: |
НОК ДМ

 На A(-)Fe – 2ē = Fe2+ 1 - окисление
На A(-)Fe – 2ē = Fe2+ 1 - окисление
На К(+)Ni2+ + 2ē = Ni 1 - восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe2+ ║ Ni2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
∆rG0 (298 К) = - z∙F∙ε0,
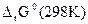 = ∆fG0 (298 К, Fe2+) - ∆fG0 (298 К, Ni2+) =
= ∆fG0 (298 К, Fe2+) - ∆fG0 (298 К, Ni2+) =
= -84,94-(-64,4) = -20,54 кДж,
ε0 = 
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
 = - 2,303∙R∙T∙lgKc;
= - 2,303∙R∙T∙lgKc;
lgKс = 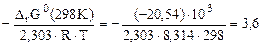
Kс = 103,6 = 3981
Ответ: ε0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10-3 г. Плотность железа равна 7,9 г/см3.
РЕШЕНИЕ:
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:
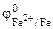 = - 0,44В,
= - 0,44В,  = - 0,26В.
= - 0,26В.
Так как 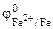 <
<  , то анодом коррозионного ГЭ будет являться железо, катодом – никель.
, то анодом коррозионного ГЭ будет являться железо, катодом – никель.
Составим схему коррозионного ГЭ:
А (-) Fe │ HCl │ Ni (+) K
или
А (-) Fe │ H+ │ Ni (+) K
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe2+
 На К 2Н+ + 2ē = Н2
На К 2Н+ + 2ē = Н2
Fe + 2H+ = Fe2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.
а)

| Рассчитываем объемный показатель коррозии KV по формуле:
KV =   , см3/м2∙час.
При расчете KV принимаем: S – [м2], τ - [час], V(газа) – [см3]. , см3/м2∙час.
При расчете KV принимаем: S – [м2], τ - [час], V(газа) – [см3].
|
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
|
|
|
Следовательно, V(газа) =  .
.
Тогда, KV =  =
=  375 см3/м2∙час.
375 см3/м2∙час.
10-4 – коэффициент пересчета, см2 в м2.
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 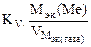 , г/м2∙час.
, г/м2∙час.
В процессе коррозии разрушению подвергается железо и выделяется водород.
Следовательно:
Мэк(Ме) = Мэк(Fe) =  =28 г/моль,
=28 г/моль,

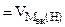 = 11200 см3/моль.
= 11200 см3/моль.
Km =  = 0,94 г/м2∙час.
= 0,94 г/м2∙час.
Ответ: KV = 375 см3/м2∙час, Km = 0,94 г/м2∙час.
б)

| Рассчитываем весовой показатель коррозии Km по формуле:
Km =  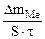 , г/м2∙час.
Коррозии подвергается железо. Тогда потеря массы металла , г/м2∙час.
Коррозии подвергается железо. Тогда потеря массы металла 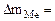  . .
|
При расчете Km принимаем:  - [г]; S – [м2], τ - [час].
- [г]; S – [м2], τ - [час].
Тогда: Km = 
 =
= 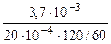 = 0,925 г/м2∙час.
= 0,925 г/м2∙час.
Рассчитываем глубинный показатель коррозии по формуле:
П = 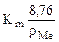 =
=  мм/год.
мм/год.
Ответ: Km = 0,925 г/м2∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Таблица 11.1. Процессы протекающие на катоде при электролизе водных растворов
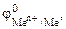 В В
| Катио-ны в вод- ном рас- творе | Зоны | Процессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li+, Rb+, Cs+ K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Al3+ | I | Катионы этих металлов на катоде не восстанавли-ваются, а концентри-руются в околокатодном пространстве (католите). На катоде восстанавливаются только молекулы воды: 2Н2О + 2ē = 2ОН- + Н2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn2+, Zn2+, Cr3+, Fe2+, Cd2+, Co2+, Ni2+, Sn2+, Pb2+ | II |  На катоде параллельно протекают два процесса:
Меn+ + nē = Me
2Н2О + 2ē = 2ОН- + Н2 На катоде параллельно протекают два процесса:
Меn+ + nē = Me
2Н2О + 2ē = 2ОН- + Н2
|
| 0,00 | Н+ | При электролизе кислоты 2Н+ + 2ē = Н2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb3+, Bi3+, Cu2+, Ag+, Pd2+, Hg2+, Pt2+ | III | Восстанавливаются только ионы этих металлов Меn+ + nē = Me |
Таблица 11.2. Последовательность окисления анионов на инертном аноде в водном растворе.
| Очередность окисления анионов | Процессы окисления на аноде. |
| 1. | Окисляются анионы бескислородных кислот (Cl-, Br-, J-, S2-, и др.) Например: 2Cl- -2ē = Cl2 |
| 2. | Окисляются ОН- ионы 4ОН- -4ē = О2 + 2Н2О |
Если в водном растворе присутствуют анионы кислородсодержащих кислот ( , , 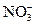 , ,  , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды.
2H2O - 4е = О2+4H+ , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды.
2H2O - 4е = О2+4H+
|
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe0 – nē = Men+
УРОВЕНЬ В
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
|
|
|
Дано:
Электролит:
K2SO4
τ = 4 ч
Т = 298 К
I = 2 A
Р = 99 кПа
Анод инертный
 1. Схема электролиза-?
2.
1. Схема электролиза-?
2.  (катод) -?
3. (катод) -?
3.  (анод) -? (анод) -?
| РЕШЕНИЕ
K2SO4 = 2K+ +  Схема электролиза:
K(-) A(+) (инертный)
K+
Схема электролиза:
K(-) A(+) (инертный)
K+  2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = О2 + 4H+
На катоде выделяется H2, на аноде выделяется О2
По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.):
2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = О2 + 4H+
На катоде выделяется H2, на аноде выделяется О2
По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.):
|
 =
= 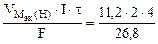 = 3,34 л.
= 3,34 л.
где  = 11,2 л/моль.
= 11,2 л/моль.
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
 =
= 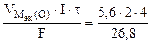 = 1,67 л,
= 1,67 л,
где 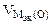 = 5,6 л/моль, т.е.
= 5,6 л/моль, т.е.  = 2
= 2 
Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:
 ,
,
откуда: 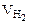 =
=  = 3,73 л
= 3,73 л
Объем кислорода при заданных условиях:
 = 1/2
= 1/2 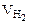 = 1,865 л.
= 1,865 л.
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см2, необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см3.
  Дано:
Электролит:
CuCl2
S = 100 см2
h = 0,15 мм
I = 8 A
BT = 98 %
ρCu = 8,9 г/см3 Дано:
Электролит:
CuCl2
S = 100 см2
h = 0,15 мм
I = 8 A
BT = 98 %
ρCu = 8,9 г/см3
 Анод медный
Схема электролиза-? Анод медный
Схема электролиза-?
 Время электролиза, τ -? Время электролиза, τ -?
|  РЕШЕНИЕ
CuCl2 = Cu2+ + 2Cl-
Схема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu – 2ē = Cu2+
На катоде выделяется Cu, на аноде растворяется Cu.
ВТ= РЕШЕНИЕ
CuCl2 = Cu2+ + 2Cl-
Схема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu – 2ē = Cu2+
На катоде выделяется Cu, на аноде растворяется Cu.
ВТ=  ; mCu(факт) =mCu(теор)·ВТ ; mCu(факт) =mCu(теор)·ВТ
|
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 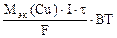 .
.
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см2, h – см, ρ – г/см3.
S∙h∙ρCu = 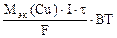 ,
,
откуда
τ =  1,43 часа,
1,43 часа,
где Mэк(Cu) = 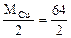 = 32 г/моль
= 32 г/моль
F = 26,8 – А∙ч/моль,
10-1 – коэффициент пересчета мм в см.
Ответ: 1,43 часа.
3. Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
  Дано:
Электролит: AgNO3
I = 4 A Дано:
Электролит: AgNO3
I = 4 A
 = 75 см3
τ = 25 мин
Анод инертный = 75 см3
τ = 25 мин
Анод инертный
 Схема электролиза-?
Схема электролиза-?
 -? -?
|  РЕШЕНИЕ
AgNO3 = Ag+ + РЕШЕНИЕ
AgNO3 = Ag+ + 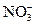 Схема электролиза:
K(-) A(+) инертный
Ag+ + ē= Ag
Схема электролиза:
K(-) A(+) инертный
Ag+ + ē= Ag 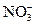 H2O 2H2O - 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
H2O 2H2O - 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
|
 Молярная концентрация эквивалента раствора AgNO3:
Молярная концентрация эквивалента раствора AgNO3:
 =
= 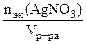
По закону эквивалентов: nэк(AgNO3) = nэк(Ag),
nэк(Ag) =  ,
,
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg =  , откуда
, откуда
 =
= 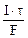 = nэк(Ag) = nэк(AgNO3)
= nэк(Ag) = nэк(AgNO3)
Молярная концентрация эквивалента раствора AgNO3:
 =
=  = 0,83 моль/л.
= 0,83 моль/л.
где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10-3 – коэффициент пересчета см3 в л.
Ответ:  = 0,83 моль/л.
= 0,83 моль/л.
|
|
|



 Уравнять реакцию и указать окислитель и восстановитель.
Уравнять реакцию и указать окислитель и восстановитель.
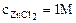
 ε -?
ε -?
 = 3,7·10-3 г.
S = 20 см 2
ρFe = 7,9 г/см3
Km -?
П -?
= 3,7·10-3 г.
S = 20 см 2
ρFe = 7,9 г/см3
Km -?
П -?