 |
Получение и химические свойства металлов
|
|
|
|
УРОВЕНЬ В
1. На 2 г смеси, состоящей из Fe, FeO, Fe2O3 подействовали хлороводородной кислотой. При этом выделилось 224 см3 (при н.у.) водорода, а при восстановлении 2 г исходной смеси до металла водородом получено 0,45 г воды. Определить состав исходной смеси (% масс.).
Дано:
Mсмеси = 2 г


| РЕШЕНИЕ: При взаимодействии смеси с хлороводородной кислотой протекают реакции: FeO + 2HCl = FeCl2 + H2O (12.4) Fe2O3 + 6HCl = 2FeCl3 + 3H2O (12.5) Водород выделяется лишь за счет реакции: Fe + 2HCl = FeCl2 + H2↑ (12.6) |
ω  -? ω -? ω  -?
ω -?
ω  -? -?
|
Cоставляем пропорцию для реакции (12.6):
 вытесняет 22,4 л H2 56 г Fe вытесняет 22,4 л Н2
вытесняет 22,4 л H2 56 г Fe вытесняет 22,4 л Н2
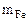 - 0,224 л H2
- 0,224 л H2 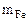 - 0,224 л Н2
- 0,224 л Н2
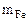 = 0,56 г
= 0,56 г
где
 = 56 г/моль масса оксидов равна:
= 56 г/моль масса оксидов равна:  +
+  = 2 – 0,56 = 1,44 г
= 2 – 0,56 = 1,44 г
При восстановлении смеси FeO и Fe2O3 водородом протекают реакции
FeO + H2 = Fe + H2O (12.7)
Fe2O3 + 3H2 = 2Fe + 3H2O (12.8)
Составляем пропорцию для уравнения (12.7)
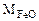 -
-  72 г/моль - 18 г/моль
72 г/моль - 18 г/моль
 -
- 
 -
- 
Откуда  =
=  = 0,25
= 0,25 
Составляем пропорцию для уравнения (12.8)
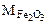 -
-  160 г/моль - 3·18 г/моль
160 г/моль - 3·18 г/моль
 -
- 
 -
- 
Откуда  =
= 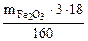 = 0,337
= 0,337 
По условию задачи
 +
+  = 0,25
= 0,25  + 0,337
+ 0,337  = 0,45 г
= 0,45 г
Составляем систему уравнений

 +
+  = 1,44 г
= 1,44 г
0,25  + 0,337
+ 0,337  = 0,45 г
= 0,45 г
Выражаем из первого уравнения 
 = 1,44 -
= 1,44 -  и подставляем во второе уравнение
и подставляем во второе уравнение
0,25·(1,44 -  ) + 0,337
) + 0,337  = 0,45 г
= 0,45 г
0,09 = 0,087 
Откуда  = 1,03 г, а
= 1,03 г, а  = 1,44 – 1,03 = 0,41 г
= 1,44 – 1,03 = 0,41 г
Определяем состав исходной смеси:
 =
= 
 =
= 
 =
= 
Ответ: состав смеси: 28% - Fe, 20,5% - FeO, 51,5% - Fe2O3
2. Составить схему получения металлического кадмия из 10 г смеси оксидов CdO и ZnO. В качестве растворителя оксидов использовать разбавленную серную кислоту. Определить состав смеси (% мас.) и массу полученного кадмия, если в качестве восстановителя CdO использовали СО, а объем образовавшегося СО2 составляет 300 см3 (н.у.)
Дано:
M  = 10 г
V = 10 г
V  = 300 см3 = 300 см3
| РЕШЕНИЕ: Составляем схему разделения оксидов и записываем уравнения реакций по стадиям: 1. Растворение оксидов кадмия и цинка в H2SO4: CdO + H2SO4 = CdSO4 + H2O (12.9) ZnO + H2SO4 = ZnSO4 + H2O (12.10) |
ω  -? ω -? ω 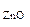 -?
m -?
m  -? -?
|
|
|
|
2. Осаждение гидроксидов кадмия и цинка гидроксидом натрия при стехиометрическом соотношении солей и гидроксида натрия:
CdSO4 + 2NaOH = Cd(OH)2↓ + Na2SO4 (12.11)
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4 (12.12)
3. Растворение амфотерного гидроксида цинка в избытке щелочи:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] (12.13)
избыток растворимая соль
Так как Na2[Zn(OH)4] - растворимая соль, то в осадке остается только гидроксид кадмия.
4. Отделение осадка Cd(OH)2 от раствора фильтрацией, промывка, сушка.
5. Разложение осадка Cd(OH)2 при нагревании:
Cd(OH)2  СdO + H2O↑ (12.14)
СdO + H2O↑ (12.14)
6. Восстановление CdO оксидом углерода (II) при нагревании:
CdO + CO  Cd + CO2 (12.15)
Cd + CO2 (12.15)
М  - 22,4 л
- 22,4 л
m  - V0(СО2)
- V0(СО2)
откуда m 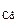 =
=  = 1,5 г
= 1,5 г
где М  = 112,4 г/моль
= 112,4 г/моль
Определяем содержание СdO в смеси по уравнению (12.16)
M  ― M
― M 
m  ― m
― m 
128,4г ― 112,4 г
m  ― 1,5 г
― 1,5 г
где M  = 128,4 г/моль,
= 128,4 г/моль,
откуда m  =
= 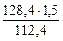 = 1,71 г
= 1,71 г
Определяем ω  =
=  =
=  ·100 = 17,1%
·100 = 17,1%
ω 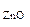 = 100 – 17,1 = 82,9%
= 100 – 17,1 = 82,9%
Ответ: состав смеси ZnO - 82,9%, CdO - 17,1%, m 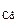 = 1,5 г.
= 1,5 г.
3. При растворении 0,5 г алюминиевой бронзы, состоящей из меди и алюминия, в хлороводородной кислоте выделилось 43,56 см3 водорода, собранного над водой и измеренного при 300К и 740 мм рт. ст. Давление паров воды при 300К равно 26,74 мм рт. ст. Определить состав сплава (% мас.)
Дано:
 = 0,5 г
HCl - растворитель
V = 0,5 г
HCl - растворитель
V 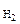 = 43,56 см3
Т = 300 К
Р = 740 мм рт.ст.
Р = 43,56 см3
Т = 300 К
Р = 740 мм рт.ст.
Р 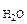 = 26,74 мм рт.ст. = 26,74 мм рт.ст.
|


|
РЕШЕНИЕ:
В соответствии со следствием из ряда стандартных электродных потенциалов металлов в хлороводородной кислоте могут растворяться только те металлы, у которых
 < 0.
< 0.
Определяем стандартные электродные потенциалы:
 = + 0,34В,
= + 0,34В,
 = -1,67В
= -1,67В
Следовательно, в хлороводородной кислоте из сплава будет растворяться только алюминий.
Уравнение реакции имеет вид:
Alo + HCl = Al+3Cl3 + H  ↑ (12.17)
↑ (12.17)


 НОК ДМ ДМ
НОК ДМ ДМ
Alo - 3e = Al+3 1 2 ДМ удваиваем, т.к.
3 после реакции образуется
H+ + e = H о 3 6 четное число атомов
водорода 
2Al + 6H+ = 2Al3+ + 6Hо
2Al + 6HCl = 2AlCl3 + 3H2↑ (12.18)
|
|
|
Массу алюминия в сплаве можно рассчитываем по уравнению реакции (12.18):
2  - 3·22400 см3 Н2
- 3·22400 см3 Н2
 -
- 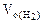
Откуда
 (12.19)
(12.19)
где  =27 г/моль
=27 г/моль
Объем водорода при н.у. (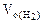 ) рассчитываем по объединенному уравнению газового состояния:
) рассчитываем по объединенному уравнению газового состояния:

Откуда: 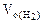 =
=  =
=
= 
где 
Подставляя величину 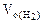 в формулу (12.19), получаем:
в формулу (12.19), получаем:

Рассчитываем содержание металлов в сплаве:


Ответ: состав сплава Al – 6%, Cu – 94%.
|
|
|


