 |
Диаграммы состояния неконденсированных систем с неограниченной растворимостью в жидком состоянии
|
|
|
|
На рис. 16 изображены проекции сечений одной из типовых диаграмм состояния двухкомпонентной неконденсированной системы, компоненты которой неограниченно растворимы в жидком состоянии, в изобарических (а) и изотермических (б) координатах. Точки ТА и T Вна рис. 16 а соответствуют температурам кипения и конденсации чистых компонентов A и В при постоянном давлении; точки Р А и Р Вна рис. 16 б указывают давление пара над этими компонентами при заданной постоянной температуре. В этих точках в безвариантном равновесии находятся две фазы – жидкость и газ (S = 1 + 1 - 2 = 0), и поэтому температура и давление остаются постоянными до тех пор, пока не закончится испарение жидких компонентов или конденсация их паров.
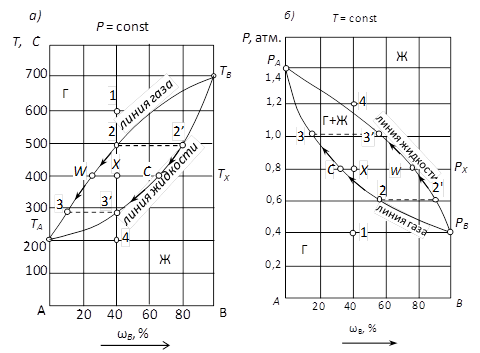 |
Рис. 16. Проекции изобарического (а) и изотермического (б) сечений диаграммы состояния неконденсированной двухкомпонентной системы.
Две наклонных линии, соединяющие указанные точки, разделяют диаграмму состояния двухкомпонентной системы на три поля. Два из них отвечают условиям существования одной фазы, состоящей из двух компонентов: газа (Г) при низком давлении и высокой температуре или раствора жидких компонентов друг в друге при высоком давлении и низкой температуре (Ж). Система, представленная одной из этих фаз, имеет две степени свободы, т.е. одновременно может изменяться состав, а также температура или давление (точки 1 и 4).
Третье поле диаграммы, расположенное между наклонными линиями, представляет две находящиеся в равновесии друг с другом фазы: жидкость и насыщенный пар, имеющие различный состав и лишь одну степень свободы. Поскольку такая система является моновариантной (S = 2 + 1 - 2 = 1), состав этих фаз зависит от температуры и давления, и при постоянном значении этих параметров также строго постоянен.
|
|
|
В соответствии с первым законом Коновалова, состав жидкости и газа в состоянии равновесия различен, причем газ, по сравнению с жидкостью, богаче тем компонентом, добавление которого повышает общее давление пара над раствором, т.е. понижает температуру кипения раствора.
Например, на рис. 16 б видно, что таким более летучим компонентом системы является вещество А, давление паров над которым при заданной температуре выше, чем у В, и поэтому, как следует из рис. 16 а, температура кипения компонента А ниже, чем у В.
Состав каждой из находящихся в равновесии фаз можно легко определить по наклонным линиям диаграммы. Линия жидкости диаграммы (рис. 16), называемая также линией испарения, показывает изменение состава жидкости, а также общее давление пара над раствором в зависимости от концентрации его компонентов. Линия газа или линия конденсации показывает состав насыщенного пара, находящегося в равновесии с жидкостью. Изменение состава этих фаз при повышении давления в системе, содержащей 40 % компонента В, показано стрелками.
Например, при давлении Р х = 0,8 атм. (фигуративная точка системы X) в равновесии находятся жидкость, содержащая 75 % компонента В и 25 % компонента А, и пар, который в соответствии с первым законом Коновалова содержит около 32 % компонента В и 68 % более летучего компонента А. Фигуративная точка системы X, а также точки W и C, называемые фигуративными сопряженными точками находящихся в равновесии фаз (соответственно газа и жидкости), расположены на одной горизонтальной прямой, носящей название нода. Длина ноды | WC |, а также отрезков ее, отсекаемых точкой X, позволяет рассчитать относительное количество находящихся в равновесии фаз по правилу рычага.
На практике чаще используются изобарические сечения диаграмм состояния двухкомпонентных неконденсированных систем. Линия жидкости на этих диаграммах позволяет определить температуру начала конденсации паров в зависимости от их состава, а также изменение состава насыщенных паров в процессе их конденсации при изменении температуры. Линия газа (испарения) жидкости показывает температуру конца конденсации паров при охлаждении системы или температуру начала испарения жидкости при нагревании в зависимости от исходного состава системы. Эта же линия позволяет определить изменение состава жидкой фазы, находящейся в равновесии с паром, при изменении температуры.
|
|
|
Например, при охлаждении газа, содержащего 40 % компонента В, от 600 до 200 °С, т.е. при движении фигуративной точки системы от точки 1 до точки 4 (рис. 16 а), его конденсация начинается при температуре 500 °С, отвечающей точке 2, лежащей на линии газа, а жидкость, которая появляется при этой температуре, содержит 80 % компонента В, что соответствует точке 2' на линии жидкости. Далее, при понижении температуры от точки 2 до точки 3', состав газа непрерывно меняется по линии газа от точки 2 до точки 3, а состав жидкости – по линии испарения от точки 2' до точки 3'. Одновременно происходит изменение количественного соотношения находящихся в равновесии фаз: количество газа непрерывно уменьшается, а количество жидкости растет, причем его можно вычислить, пользуясь правилом рычага. Так, например, при 400 °С нода, соединяющая фигуративные точки газа Г и жидкости Ж, разделена фигуративной точкой системы X на два отрезка. Длина отрезка CХ пропорциональна количеству газа, а отрезка WX - количеству жидкой фазы. Конденсация газа заканчивается при температуре 275 °С, при которой исчезают остатки газа состава, отвечающего точке 3, и остается жидкая фаза, состав которой отвечает исходному составу системы: 40 % компонента В (точка 3').
Во многих случаях наблюдаются весьма значительные отклонения свойств растворов реальных веществ от свойств идеальных растворов. Поэтому на диаграммах состояния на линиях газа и жидкости отмечают экстремальные точки: максимум или минимум. Если имеет место отрицательное отклонение от давления паров, отвечающего идеальным растворам, на линиях газа и жидкости изотермической бинарной системы появляется минимум, которому на изобарической диаграмме соответствует максимальная температура кипения (рис. 17, а). При положительных отклонениях от свойств идеальных растворов на кривых газа и жидкости может появиться максимум, при этом максимальному давлению
 |
пара отвечает минимальная температура кипения (рис. 17, б).
|
|
|
Рис. 17. Экстремальные точки на кривых конденсации и испарения.
Второй закон Коновалова гласит: «В экстремальных точках диаграммы составы жидкости и газа одинаковы, и этим точкам соответствует общая горизонтальная касательная». Жидкости, состав которых соответствует экстремумам на диаграммах, называются азеотропными или нераздельно кипящими.
Различия в составе жидких фаз и паров широко используются при разделении веществ методом простой или фракционной перегонки (дистилляции). Если на диаграмме состояния нет экстремальных точек, то можно получить компоненты в чистом виде, в противном случае фракционная перегонка позволяет получить чистым лишь один из компонентов и азеотропную жидкость, содержащую оба компонента.
|
|
|


