 |
Диаграмма растворимости в воде двух солей с одноименным ионом
|
|
|
|
Простейшая диаграмма растворимости в воде двух солей с одноименным ионом без образования двойных солей и кристаллогидратов приведена на рис. 65. Граничные линии диаграммы делят ее на четыре поля.
 |
Рис. 65. Трехкомпонентная диаграмма растворимости двух солей с одноименным ионом в треугольнике Гиббса (а) и в прямоугольных координатах (б).
На диаграмме в треугольнике Гиббса (рис. 65-а) для расшифровки диаграммы может быть использован принцип преимущественной кристаллизации «хозяина» поля (показано стрелками). Тогда в поле I «хозяином» является вода и в этом поле, очевидно, присутствует ненасыщенный раствор обеих солей в воде. Для поля II «хозяином» является соль AY, следовательно, в данном поле присутствуют кристаллы AY и равновесная с ними жидкость – раствор, насыщенный по AY. Тогда линия SAY - E является линией раствора, насыщенного по AY, т.е. линией растворимости соли AY в присутствии соли АХ. Для поля IV «хозяином» является соль AX, следовательно в поле IV в равновесии будут находиться кристаллы AX и раствор, насыщенный по AX. Линия SAX - E является линией растворимости соли AX в присутствии AY.
Точки SAY и SAX на диаграмме выражают соответственно растворимость чистых солей AY и AX в воде. Исходящие из них линии характеризуют составы растворов, насыщенных одной из солей и не насыщенных другой. Точка пересечения этих линий Е соответствует составу раствора, одновременно насыщенного обеими солями. Эта точка и соответствующая ей жидкость называются эвтоническими. Поле III диаграммы соответствует одновременному существованию находящихся в равновесии трех фаз: эвтонической жидкости, насыщенной двумя солями, и кристаллов этих солей.
|
|
|
Описанная диаграмма получена при определенных условиях (давлении и температуре), выбранных таким образом, что парообразная фаза отсутствует. При изменении условий существования системы положение граничных линий и эвтонической точки смещаются. Плоская диаграмма трехкомпонентной водно-солевой системы, по сути, является изотермическим сечением объемной диаграммы, для которой третья координата – температура.
Для рассмотрения процессов в системе, происходящих при изменении состава раствора, например, при увеличении массы одного из компонентов, применимо правило луча. При этом используется приближение изотермического испарения растворителя. Фигуративная точка системы при этом перемещается по лучу, проведенному из точки начала координат диаграммы (рис. 65-б).
В точке 1 система представляет собой ненасыщенный раствор, содержащий 50 г AX и 80 г AY. При упаривании раствора отношение между компонентами AX и AY не меняется, поэтому точка перемещается по прямой линии, идущей от начала координат.
В точке 2, лежащей на линии растворимости SAY - E раствор оказывается насыщенным по компоненту AY. Линия SAY - E является граничной линией поля I, где существует однофазная система. Раствор в точке 2 содержит 100 г AX и 150 г AY.
По мере дальнейшего упаривания растворителя фигуративная точка системы переходит в поле II, где происходит образование кристаллов AY. Здесь система распадается на две фазы: в точке 3 находится раствор состава 3', содержащий 150 г AX и 135 г AY, и кристаллы AY. Правило рычага для диаграмм состояния водно-солевых систем в прямоугольных координатах неприменимо, т.к. нода бесконечна. Количество кристаллов AY легко можно определить по диаграмме, построенной по методу Шрайнемакерса. Общий состав системы определяется по перпендикулярам, проведенным из данной точки на оси состава. В точке 3 система содержит 150 г AX и 230 г AY. Тогда  . Массовая доля твердой фазы составляет
. Массовая доля твердой фазы составляет
|
|
|
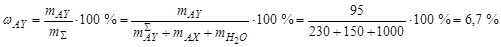 .
.
При продолжении уменьшения доли растворителя система перейдет в точку 4, в которой по-прежнему содержится две фазы: раствор состава Е, содержащий 200 г AX и 120 г AY, и кристаллы AY. Точка 4 является граничной между полями II и III. Система в точке 4 содержит 200 г AX и 300 г AY.
Масса кристаллов AY:  . Массовая доля твердой фазы составляет:
. Массовая доля твердой фазы составляет:
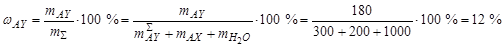 .
.
Дальнейшее увеличение концентрации раствора приведет систему в точку 5, расположенную в поле III, в котором происходит совместная кристаллизация компонентов AX и AY. В поле три в равновесии находятся три фазы: кристаллы AX, кристаллы AY и эвтонический раствор состава Е, насыщенный по обоим компонентам. Общий состав системы в точке 5: AX – 250 г, AY – 380 г, Н2О – 1000 г. Эвтонический раствор содержит 200 г AX и 120 г AY.
Масса кристаллов AX:
 ,
,
масса кристаллов AY:
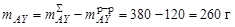 .
.
Массовая доля твердой фазы:

Массовая доля кристаллов AY в составе твердой фазы:
 .
.
Увеличение концентрации раствора приведет систему в точку 6, содержащую 300 г AX и 445 г AY на 1000 г воды. Как и в точке 5, в точке 6 в равновесии находятся 3 фазы: раствор состава Е, насыщенный по обеим солям, и две твердые фазы: кристаллы AX и AY.
Масса кристаллов AX:
 ,
,
масса кристаллов AY:
 .
.
Массовая доля твердой фазы:

Массовая доля кристаллов AY в составе твердой фазы:
 .
.
Точки 1-5 нанесены и на треугольник составов на рис. 65а. Путь кристаллизации также проходит по лучу, проведенному из вершины треугольника, занимаемой водой. Фазовый состав в этих точках такой же, как и на рис. 65б. Преимущество треугольника составов перед диаграммой в прямоугольных координатах состоит в возможности построения нод и использовании правила рычага. Определим составы и количества фаз в точке 3. В равновесии кристаллы АY и насыщенный раствор. Нода 3΄-АY проходит через фигуративную точку и соединяет составы равновесных фаз. Состав раствора определяется координатами точки 3΄.


В точке 4 равновесие AYТ = ЖЕ

В точке 5 равновесие АYТ + AXТ = ЖЕ
Нода Е-5΄


В точке k конец кристаллизации.
|
|
|


