 |
38. Первое начало термодинамики и его недостатки. Внутренняя энергия, работа, теплота.
|
|
|
|
38. Первое начало термодинамики и его недостатки. Внутренняя энергия, работа, теплота.
Первое начало термодинамики – обмен энергии характеризуется количеством переданного тепла
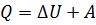
Первое начало термодинамики имеет недостаток – не указывает в каком направлении идет процесс изменения состояния.
Внутренняя энергия – тепловое хаотическое движение. Оно определяется из теплового хаотического движения молекул.
Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется количеством теплоты́ или просто теплотой.
Работа газа – работа, которую газ совершает газ при переходе из одного состояния в другое.
39. Удельная и молярная теплоемкости и. г.. Уравнение Майера. Связь U и C.
Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу, к изменению температуры δ Т, которое при этом произошло.
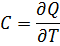
Молярная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моль вещества.
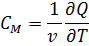
Уравнение Майера
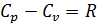



Связь между U и C

40. Число степеней свободы молекул и. г.. Закон о равномерном распределении энергии.
Для  I имеет следующие значения
I имеет следующие значения
Одноатомный (i=3)
Двухатомный (i=5)
Многоатомный (i=6)
Закон Больцмана о равномерном распределении кинетической энергии
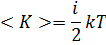
41. Работа газа. Графическое изображение работы. Работа газа при изопроцессах.

Изобарный процесс (p = const). При изобарном процессе работа газа при увеличении объема от V1 до V2 равна:
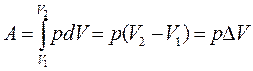 ,
,
а первое начало термодинамики для изобарного процесса примет вид:
 .
.
2. Изохорный процесс (V = const). При изохорном процессе газ не совершает работы против внешних сил, то есть А=0, а первое начало термодинамики для изохорного процесса примет вид:
|
|
|
 .
.
т. е. все количество теплоты, сообщаемое газу, расходуется на увеличение его внутренней энергии.
3. Изотермический процесс (T=const). Работа при изотермическом расширении газа:
 .
.
…
Так как при постоянной температуре внутренняя энергия идеального газа не изменяется, то первое начало термодинамики для изотермического процесса:
 ,
,
то есть все количество теплоты Q, сообщаемое газу, расходуется на совершение им работы A против внешних сил.
Формулы для вычисления работы при постоянном давлении:
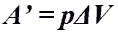 - Работа газа при изобарном процессе (p = const)
- Работа газа при изобарном процессе (p = const)
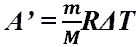 - Работа газа при изобарном процессе (p = const)
- Работа газа при изобарном процессе (p = const)
42. Графики и уравнения изохоры, изобары, изотермы, адиабаты. Внутренняя энергия, теплота и работа при изопроцессах. Теплоемкость при изопроцессах.
Макропараметры: давление, объем и температура описывают состояние газа. Если при неизменной массе газа один из параметров не изменяется, получим изопроцессы.

Графики изопроцессов
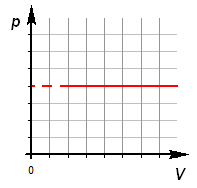
Изобарный процесс.


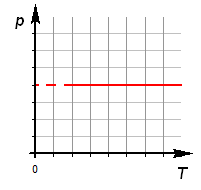
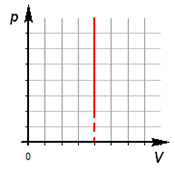
Изохорный процесс



Изотермический процесс
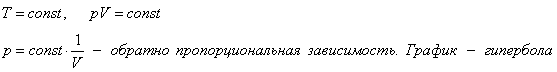


Изопроцессы - процессы, протекающие при неизменном значении одного из параметров.
Изотермический процесс (T = const, следовательно Δ U = 0).
По первому закону термодинамики: Q = A'.
Газ совершает работу A' за счет подводимого тепла Q (A'> 0, Q> 0).
Совершение работы внешними силами A (сжатие газа) требует отвода тепла Q от газа для сохранения его температуры (A> 0, Q< 0).
Изохорный процесс (V = const, следовательно A = 0).
По первому закону термодинамики: Δ U = Q.
Нагревание газа в закрытом сосуде приводит к увеличению его внутренней энергии U (температуры) (Q> 0, Δ U> 0).
Охлаждение газа в закрытом сосуде приводит к уменьшению его внутренней энергии U (температуры) (Q< 0, Δ U< 0).
Изобарный процесс (p = const).
|
|
|
По первому закону термодинамики: Q = Δ U + A'.
Подводимое к газу тепло Q частично идет на увеличение внутренней энергии U, а частично на совершение работы газом A' (Q> 0, Δ U> 0, A'> 0).
Работа внешних сил A при изобарном сжатии газа требует отвода тепла Q от газа, одновременно уменьшается его внутренняя энергия U (Q< 0, Δ U< 0, A> 0).
Адиабатный процесс - процесс, протекающий без теплообмена с окружающей средой (Q = 0).
По первому закону термодинамики: Δ U = A.
Вся работа внешних сил А идет только на увеличение внутренней энергии газа (A> 0, Δ U> 0).
Работа газа А' совершается только за счет потери внутренней энергии.
|
|
|


