 |
69. Определение ЭДС гальванического элемента. Элемент Даниэля-Якоби. Устройство и принцип работы свинцового кислотного и железоникелевого щелочного аккумуляторов.
|
|
|
|
69. Определение ЭДС гальванического элемента. Элемент Даниэля-Якоби. Устройство и принцип работы свинцового кислотного и железоникелевого щелочного аккумуляторов.
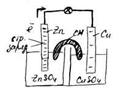
Гальванический элемент состоит из двух электродов — анода и катода. Его устройство и принцип работы рассмотрим на примере элемента Даниэля-Якоби. В этом элементе используют медный и цинковый электроды. Каждый электрод помещен в ёмкость с раствором электролита, катионы которых " одноимённый" материалу электрода. Ёмкости разделены перегородкой. Цинковый электрод опущен в раствор ZnSO4. При замыкании цепи гальванического элемента между электродом и раствором электролита идёт реакция окисления:
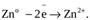
Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны; таким образом цинковая пластинка заряжается отрицательно и становится анодом. Возникает отрицательный электродной потенциал 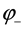 .
.
Между медным электродом и окружающем его раствором CuSO4 идёт реакция восстановления:
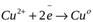
Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом. Электродный потенциал его будет равен 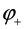 .
.
Рассмотрим гальванический элемент Якоби-Даниэля.
Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Схема гальванического элемента:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
Zn-2e « Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
|
|
|
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn - 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е « Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
движение электронов во внешней цепи;
движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Zn2+ + Сu.
Аккумулятор – химический источник тока, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию и по мере необходимости отдавать её во внешнюю цепь.
Аккумулятор сам не производит электрическую энергию. Он только накапливает её при заряде: пропускание тока от постороннего источника сопровождается превращением электрической энергии в химическую, в результате, аккумулятор сам становится источником тока.
|
|
|
В зависимости от состава электролита различают:
· кислотные
· и щелочные аккумуляторы.
Простейший кислотный аккумулятор состоит из двух свинцовых электродов, погруженных в раствор серной кислоты.
 Процессы, проходящие в кислотном аккумуляторе, можно представить следующим уравнением:
PbO2+Pb+2H2SO4 2PbSO4+2H2O РbO2 –порошок перекиси свинца;
|
|
|


