 |
Тема. 2.3: Кислородсодержащие органические соединения
|
|
|
|
Перечень изучаемых вопросов:
1.Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение глицерина.
2.Фенол. Физические и химические свойства фенола.Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Применение фенола на основе свойств.
3.Альдегиды. Понятие об альдегидах. Альдегидная группа как функциональная. Формальдегид и его свойства: окисление в соответствующую кислоту,восстановление в соответствующий спирт. Получение альдегидов окислением соответствующих спиртов. Применение формальдегида на основе его свойств.
4.Карбоновые кислоты. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная. Гомологический ряд предельных однооснóвных карбоновых кислот. Получение карбоновых кислот окислением альдегидов. Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Применение уксусной кислоты на основе свойств. Высшие жирные кислоты на примере пальмитиновой и стеариновой.
5.Сложные эфиры и жиры.Получение сложных эфиров реакцией этерификации. Сложные эфиры в природе, их значение. Применение сложных эфиров на основе свойств. Жиры как сложные эфиры. Классификация жиров. Химические свойства жиров: гидролиз и гидрирование жидких жиров. Применение жиров на основе свойств.Мыла.
|
|
|
6.Углеводы.Углеводы, их классификация: моносахариды (глюкоза, фруктоза), дисахариды (сахароза) и полисахариды (крахмал и целлюлоза). Глюкоза – вещество с двойственной функцией – альдегидоспирт. Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, спиртовое брожение. Применение глюкозы на основе свойств. Значение углеводов в живой природе и жизни человека. Понятие о реакциях поликонденсации и гидролиза на примере взаимопревращений: глюкоза ¾® полисахарид.
Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение. Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение глицерина.
Определение, классификация, строение спиртов и гомологический ряд
| циклогексанол |


«ОН» - функциональная группа спиртов и фенолов. В фенолах она связана с углеродом ароматического ядра, в спиртах – с любым углеродным атомом.
СН3 – СН2ОН – этиловый спирт


СН2 – СН - СН2ОН – аллиловый спирт
Одноатомные спирты имеют общую формулу R – OH, или Ar – (СН2)n- OH,
| СnH2n+1ОН |

Спирты могут быть первичные, вторичные, третичные
Номенклатура. Изомерия
3 2 1 4 3 2 1
| 3- бутен – 1-ол |
| 3- бутен – 1-ол |
| 2- бутен – 1-ол |
| 3- бутен – 2-ол |

Способы получения
Гидратация алкенов
СН2 = СН2 + Н2О → + Н2О → СН3 - СН2ОН
СН2= СН - СН3ОН → СН3 – СН – СН3
|
OH
В промышленности гидратация олефинов проводится двумя способами: при участии серной кислоты сернокислотная гидратация и прямая гидратация.
|
|
|
СН2 = СН2 + НОSO2OH → СН3 - СН2 – ОSO2ОН
СН3 - СН2– ОSO2ОН + Н2О → СН3 - СН2ОН + H2SO4
Прямую гидратацию проводят в одну стадию:
| t, p |
 СН3 - СН2ОН
СН3 - СН2ОН
2)
| О |
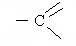
| СН3 |
| Н |
 СН3 - СН2ОН
СН3 - СН2ОН

| O |
|
OH
|
|
|


