 |
Восстановление кислот и сложных эфиров
|
|
|
|
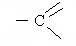
| R |
| O-R’ |
| О |
| кат |
 R – СН2ОН
R – СН2ОН

R – СН2ОН + R1 – OH
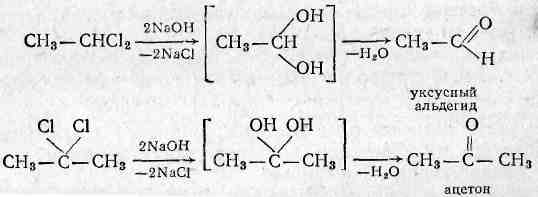
4) Гидролизом галогеналкилов при нагревании с водой раствором щелочей (в первом случае реакция обратима)
HOH С2Н5OH + HCl
С2Н5Cl
NaOH
С2Н5OH + NaCl
Действием металлорганических соединений на альдегиды и кетоны
 Н2С =О + СН3MgJ →СН3 - СН2ОMgJ СН3 - СН2ОН +MgJ(OH)
Н2С =О + СН3MgJ →СН3 - СН2ОMgJ СН3 - СН2ОН +MgJ(OH)
ОMgJ
| О |
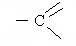
| Н3С |
| Н |
 |
|
+ СН3MgJ →СН3 – СН СН3 – СН – СН3 +MgJ(OH)
| |
СН3 OH
| СН3 |
 | |
| |
C = O+ СН3MgJ →СН3 – СН - СН3 СН3 – СН – СН3 +MgJ(OH)
| | |
СН3 СН3 СН3
Получение спиртов брожением (этилового и бутилового)
С6Н12OH → 2 СО2 + 2С2Н5OH
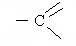
| R |
| OН |
| О |
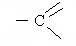
| R |
| O-R’ |
| О |
 + R1 – OH
+ R1 – OH
Химические свойства
Химическое поведение определяется в первую очередь наличием в их молекуле функциональной группы ОН.

Особое место занимают два типа реакций замещения, протекающие с разрывом связи С- О и О-Н.
Также для спиртов характерны реакции отщепления (элиминирования). Окисления, дегидратации. Положение гидроксильной группы ОН и молекулярная масса существенно влияет на химическое поведение спиртов.
Реакции с разрывом связи О-Н.
Образование алкоголятов.
Спирты – очень слабые кислоты, но взаимодействуя с металлами (K, Na,Mg, Al), образуют алкоголяты:
2СН3 → СН2ОН +2Na →СН3 - СН2ОNa + Н2↑
СН3 - СН2ОNa + HOH →СН3 - СН2ОH + NaOH
Легче всего замещается атом водорода в металле. Труднее в третичных спиртах.
Образование сложных эфиров. Реакция этерификации

| [H+] |

| На холоду |



| На холоду |

 Первичные спирты реагируют быстрее вторичных, вторичные быстрее третичных.
Первичные спирты реагируют быстрее вторичных, вторичные быстрее третичных.|
|
|
Легче, чем с кислотами, спирты образуют сложные эфиры при взаимодействии с хлорангидридами и ангидридами кислот.
| О |
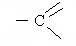
| СН3 |
| Сl |
| O |
+ СН3OH → СН3 – С - СН3 + HCl
| Ацетил хлорид |
| О |
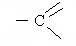
| СН3 |
| О |
| О |
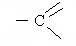
| СН3 |
| О |
| О |
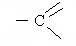
| СН3 |
| ОН |
| O |
+ СН3OH → СН3 – С - СН3 +
Реакции, протекающие с разрывом связи С-ОН
Замещение гидроксильной группы в молоке спирта на атом галогена.
С2Н5OH + HCl С2Н5Сl + H2O
С2Н5OH + PCl → С2Н5Сl + POCl3 + HCl
Дегидратация спиртов
Дегидратация или дегидратирование приводит к образованию этиловых углеводородов или простых эфиров.
СН3 - СН2ОН → СН2 = СН2 + H2O

СН3 - СН2ОН + НО - СН2 - СН3 → СН3 - СН2 – О - СН2 - СН3 + H2O
При образовании молекулы воды, водород (по правилу Зайцева) всегда отнимается от наименее гидратированного атома «С», находящегося по соседству с атомом углерода несущим гидроксильную группу. Первичные спирты дегидратируются труднее вторичных, легче всего отщепляется молекула воды от третичных спиртов.
Окисление спиртов
При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, окисление третичных спиртов сопровождается разрывом углеродной цепи, обычно около атома углерода несущего гидроксильную группу

| R |
| OН |
| О |

| кат |



| O |
|
R- СНОН R – С –R1

Дегидрирование спиртов
| 2500С |
| 2500С |

| 2500С |
| 2500С |
| ||
OH О
Многоатомными называются спирты, соединяющие в молекуле 2 гидроксильные группы и более.
В зависимости от числа гидроксильные групп «ОН» они подразделяются на двухатомные (2группы ОН), или диолы, трехатомные (3группы ОН) или триолы, и т.д.
Двухатомные спирты также называются гликолями.



| СН3 - СН2 |
|
|
|
Изомерия многоатомных спиртов обусловлена строением радикала, и положением гидроксильных групп, а также их пространственным расположением.
Для наименования многоатомных спиртов к окончанию – ол – прибавляют приставку ди, три и т.д. соответствующее количеству гидроксильных групп, положение которых указывается цифрами.

|
|
|


