 |
Глицерин, его значение: нитроглицерин, динамит, применение.
|
|
|
|
СН2OH – СНОН - СН2ОН-1,23пропан триол.
Глицерин получается из жиров или синтезом из пропилена или ацетилена.
| СН2OH – СНОН-СН2ОН + 3С15Н31COOH |
| +3 НОН |

| кат |
| С15Н31 |
| С15Н31 |
| + 3 NaОН |
| С15Н31 |
| СН2OH – СНОН-СН2ОН + 3С15Н31COOH |
м
 Синтез глицерина из пропилена
Синтез глицерина из пропилена

| Аллиловый спирт |
| - НСl |

| гидролиз |
| СН2OH – СНСl-СН2 OHСН2ОН |
| Монохлоргидрины глицерина |
| СН2OH – СНОН-СН2ОН |
| СН2Сl–СНOH-СН2OHСН2ОН |
Глицерин - нейтральная вязкая бесцветная жидкость, сладкая на вкус, tпл = 170С, пл – 1,26, очень гигроскопичен. Смешивается с водой в любых отношениях. При атмосферном давлении кипит при tпл = 2900С.
Химические свойства
В глицерине 3 гидроксильные группы. Водородные атомы гидроксильных групп замещаются на металлы при действии не только щелочных металлов, но и гидроксидов железа, меди, Ca, Ba и др. Полные соединения называются глицератами (как с этиленгликолем).

| СН3 |
| СН3 |
| СН3 |

При взаимодействии глицерина с неорганическими и органическими кислотами образуются полные и неполные сложные эфиры.
O
 ||
||
3 НО – С – CH3
 Большое практическое значение имеют полиэфиры глицерина и ароматической двухосновной кислоты (фталевые кислоты). Эти полиэфиры глицеринофталевые смолы (глифтали) применяются для изготовления лаков. При дегидратации глицерина (нагревание с гидросульфатом калия и некоторыми другими водоотнимающими средствами) образуется неправильный альдегил акролеин.
Большое практическое значение имеют полиэфиры глицерина и ароматической двухосновной кислоты (фталевые кислоты). Эти полиэфиры глицеринофталевые смолы (глифтали) применяются для изготовления лаков. При дегидратации глицерина (нагревание с гидросульфатом калия и некоторыми другими водоотнимающими средствами) образуется неправильный альдегил акролеин.
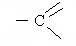
| О |
| Н |

СН2OH – СН2 – СН = О СН2 = СН - акролеин.
2.Фенол. Физические и химические свойства фенола.Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Применение фенола на основе свойств.
|
|
|
Фенолы – это вещества, в которых гидроксогруппа соединена непосредственно с бензольным кольцом.
Назовите молекулярную формулу фенил-радикала: C6H5 – фенил. Если к этому радикалу присоединить одну или несколько гидроксильных групп, то мы получим фенолы. Обратите внимание на то, что гидроксильные группы должны быть непосредственно связаны с бензольным кольцом, в противном случае мы получим ароматические спирты.
Классификация
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы, содержат в молекуле одну гидроксильную группу:

Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:

Самый главный представитель этого класса – фенол. Название этого вещества и легло в основу названия всего класса – фенолы.
Многие из вас в скором будущем станут врачами, поэтому о феноле они должны знать как можно больше. В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств. Большинство этих лекарств — производные получаемой из фенола салициловой кислоты: o-HOC6H4COOH. Самое распространенное жаропонижающее — аспирин не что иное, как ацетилсалициловая кислота. Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол. При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК). Ну и, наконец, при конденсации фенола с фталевым ангидридом получается фенолфталеин, он же пурген.
Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанные с одной или несколькими гидроксигруппами.
Как вы считаете, почему фенолы выделили в отдельный класс, хотя они содержат ту же гидроксильную группу, что и спирты?
|
|
|
Их свойства сильно отличаются от свойств спиртов. Почему?
Атомы в молекуле взаимно влияют друг на друга. (Теория Бутлерова).
Бензольное кольцо изменило свойства гидроксогруппы!
Рассмотрим свойства фенолов на примере простейшего фенола.
История открытия
В 1834г. немецкий химик-органик Фридлиб Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с характерным запахом. Ему не удалось определить состав вещества, сделал это в 1842г. Огюст Лоран. Вещество обладало выраженными кислотными свойствами и было производным открытого незадолго до этого бензола. Лоран назвал его бензол феном, поэтому новая кислота получила название фениловой. Шарль Жерар считал полученное вещество спиртом и предложил называть его фенолом.
Физические свойства
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество, tпл = 430C, tкип = 1820C, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком, поэтому с фенолом необходимо обращаться осторожно!
Сам фенол и его пары ядовиты. Но существуют фенолы растительного происхождения, содержащиеся, например, в чае. Они благоприятно действуют на организм человека.
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде.
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
Изомерия и номенклатура
Возможны 2 типа изомерии:
· изомерия положения заместителей в бензольном кольце;
· изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Химические свойства
|
|
|
Посмотрите внимательно на структурную формулу фенола и ответьте на вопрос: «Что такого особенного в феноле, что его выделили в отдельный класс?»
Т.е. фенол содержит и гидроксильную группу и бензольное кольцо, которые, согласно третьему положению теории А.М. Бутлерова, влияют друг на друга.
Свойствами каких соединений формально должен обладать фенол? (спиртов и бензола.)
Химические свойства фенолов обусловлены именно наличием в молекулах функциональной гидроксильной группы и бензольного кольца. Поэтому химические свойства фенола можно рассмотреть как по аналогии со спиртами, так и по аналогии с бензолом.
Вспомните, с какими веществами реагируют спирты.
|
|
|


