 |
Общие для большинства почв реакции
|
|
|
|
Сложность состава почв, большой набор химических соединений обусловливают возможность одновременного протекания различных химических реакций и способность твердых фаз почв поддерживать сравнительно постоянным состав почвенного раствора, откуда растения непосредственно черпают питательные вещества. Эту способность поддерживать постоянным состав почвенного раствора называют буферностью почв. При потреблении какого-либо элемента из почвенного раствора происходит частичное растворение твердых фаз и концентрация раствора восстанавливается. Если в почвенный раствор извне попадают дополнительные количества каких-либо соединений, то твердые фазы почв связывают такие вещества, вновь поддерживая постоянство состава почвенного раствора.
Общие для большинства почв реакции следующие:
1. Катионный обмен. Для почв наиболее характерны реакции катионного обмена между твёрдой частью почвы, которая поглощает катионы, и почвенным раствором, который можно рассматривать как раствор электролитов. Если твёрдую часть почвы обозначить символом П, как это принято в почвенной литературе, то при добавлении к почве раствора КС1 произойдёт реакция:
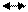 ПСа, Мg + 4КС1 ПK4 + СаС12 + МgС12
ПСа, Мg + 4КС1 ПK4 + СаС12 + МgС12
Это означает, что почва содержала в обменной форме и Са2+ и Мg2+, которые были вытеснены в раствор, а ионы К+ были поглощены почвой[34].
2. Потенциальная кислотность почв. Обменные катионы участвуют также в формировании потенциальной кислотности почв. Такая кислотность встречается в кислых дерново-подзолистых, серых лесных, красноземных почвах. Проявляется она только при воздействии на почву солевого раствора так же как и при обычной реакции катионного обмена. Отличие состоит в том, что потенциальная кислотность обусловлена только катионами Н+ и Аl3+: ПН + KCl ПК+ + НСl, или
|
|
|
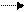
 ПAl3+ + 3KCl ПК+3 + AlCl3 + Al(OH)3 + 3HCl
ПAl3+ + 3KCl ПК+3 + AlCl3 + Al(OH)3 + 3HCl
И в том и в другом случае в растворе, появляется некоторое количество НС1, что и создает кислую реакцию среды.
Устраняют потенциальную кислотность добавлением карбоната кальция (извести), которая нейтрализует различные формы кислотности:

 ПН2+ + CaCO3 ПCa2+ + H2CO3 ПCa2+ + H2O
ПН2+ + CaCO3 ПCa2+ + H2CO3 ПCa2+ + H2O
Природная кислотность почв может быть вызвана органическими кислотами, попадающими в почву с растительными остатками или корневыми выделениями, диоксидом углерода в почвенном воздухе и поступлением азотной и серной кислот с кислыми дождями.
Растворение СO2 приводит к образованию угольной кислоты H2CO3. Сама по себе это довольно слабая кислота, но в почвенном воздухе доля СО2 много выше, чем в атмосферном; в последнем доля СO2 составляет около 0,03%, а в почвенном воздухе достигает целых процентов. Поэтому в некарбонатных почвах только за счет СО2 величина рН может опускаться до 4,5 и даже ниже.
3. Щелочность почв. Щелочными считают почвы, водная суспензия которых имеет рН 7,5 — 8,0 или выше. Щелочность вызывается различными солями: карбонатами, фосфатами, боратами, гуматами, силикатами. Но главную роль играют Nа2СО3 и СаСО3, последний создает кислотно-основную буферность и сравнительно высокую щелочность. Регулирование реакции осуществляется в этом случае за счет карбонатно-кальциевой систем. Карбонат кальция присутствует в твердой части почвы, вода в почве имеетсяпочти всегда (за исключением сильных засух), а СO2 всегда есть в почвенном воздухе. Почвенный раствор такой системы содержит разные количества Са2+, СО32-, Н+, НСО3-, и величина рН регулируется, по сути, только парциальным давлением СО2.
Щелочность почв неблагоприятно сказывается на их химических и физических свойствах. Под действием, щелочной среды почвы расплываются, теряют структурность, а затем при высыхании сливаются в плотные, очень прочные глыбы, которые часто не поддаются действию плуга. Таковы солонцы в зонах черноземных, каштановых и бурых почв.
|
|
|
Засоление почвы. В бессточных впадинах сухих регионов страны, в приморских районах почвы нередко содержат высокие концентрации легкорастворимых, солей. Это хлориды кальция, магния, натрия и калия, сульфаты, некоторые карбонаты, нитраты. Избыток легкорастворимых солей отрицательно сказывается на развитии растений, поскольку они повышают осмотическое давление почвенных растворов, а некоторые катионы и анионы токсичны для растений. Засоленных почв особенно много в Предкавказье, в Прикаспийской низменности, в Средней Азии (Муравьев, 2008).
Однако легкорастворимые соли сравнительно подвижны, и их довольно просто удалить из почвы путем обычного промывания водой. В щелочных почвах неблагоприятные вещества сначала нейтрализуют гипсом, отработанной серной кислотой, сульфатами железа, а затем образующиеся легкорастворимые соли также отмывают водой. Этот метод мелиорации засоленных почв очень широко распространен, но успех зависит от возможности удаления промывных вод. В противном случае промывные воды смыкаются с подземными грунтовыми водами, повышая их уровень. В результате возникает опасность вторичного засоления почв за счет поднимающихся к поверхности соленых грунтовых вод.
4. Окислительно-восстановительные режимы. Практически в каждой почве происходят реакции окисления или восстановления химических соединений или элементов. Эти реакции являются сопряженными, и если какой-либо компонент почвы окисляется, то другой неизбежно восстанавливается. Наиболее простой и распространенный вариант — окисление-восстановление ионов железа:
 Fe2+-e- Fe3+
Fe2+-e- Fe3+
восстановитель окислитель
Окислительные процессы идут за счет кислорода воздуха, при этом органические вещества почвы окисляются или частично, или полностью до конечных продуктов распада – Н2О и СО2. При высоких окислительно-восстановительных потенциалах порядка 0,5 — 0,7 В практически все элементы с переменной валентностью приобретают высшие степени окисления, многие из них становятся малоподвижными и малодоступными растениям. Таковы ионы железа, меди, кобальта, серы, азота. Исключение составляет марганец, для перевода которого из Мn2+ в Мn7+ необходимы потенциалы около 1,4—1,5 В; тогда как даже в наиболее аэрированных и малоувлажненных почвах максимальные значения потенциалов редко превышают 0,6 — 0,7 В.
|
|
|
В переувлажненных почвах, особенно в затопляемых рисовых почвах, развиваются восстановительные процессы, потенциалы снижаются до ±0,2 В, что обусловлено деятельностью микроорганизмов, способных развиваться без доступа свободного О2 и выделяющих в почву органические восстановленные соединения и свободный водород. В таких почвах элементы с переменной валентностью переходят в состояние низших степеней окисления, становятся подвижными, выделяется метан СН4, другие углеводороды. Когда длительно развиваются восстановительные процессы, в почвах появляется сизоватая окраска, железо и марганец восстанавливаются до Fе2+ и Мn2+. Такие почвы называют оглеенными или глеевыми. Кстати, переувлажненные или орошаемые и затопляемые почвы служат одним из важнейших природных источников выделения в атмосферу метана и других углеводородов, вызывающих проявления «парникового» эффекта.
5.Гумификация. Это один из самых важных почвенных биохимических процессов. Сущность его заключается в трансформации растительных остатков в своеобразные, темноокрашенные органические гуминовые вещества[35] преимущественно кислотной природы. В основе гуминовых веществ лежат бензолсодержащие фрагменты, их подвижная часть представлена большим набором аминокислот и моносахаридов, они содержат азот и различные кислородсодержащие функциональные группы: карбоксильные - СООН, гидроксильные - ОН, хинонные и другие. Особенность гуминовых веществ заключается в высокой устойчивости к гидротермическим и биохимическим условиям; их возраст, датированный по 14С, достигает сотен и тысяч лет, а молекулярные массы составляют десятки тысяч атомных единиц массы.
|
|
|
Функции гуминовых веществ в почвах разнообразны и чрезвычайно важны. Они аккумулируют элементы питания растений, защищают почвенные минералы от выветривания, способствуют миграции катионов различных металлов в форме комплексных соединений, регулируют тепловой и кислотно-основный режимы почв, влияют на емкость катионного обмена и на буферность почвы, обладают выраженной физиологической активностью и способны стимулировать рост и развитие сельскохозяйственных растений. Гуминовые кислоты и их соли (гуматы) получают из различного природного сырья и используют не только в сельском хозяйстве, но также в промышленности и медицине.
|
|
|


