 |
Задания районных олимпиад по химии
|
|
|
|
Республика Татарстан, 2006-2007 учебный год
Задачи для 11 класса
ЗАДАЧА 1
Расшифруйте схему превращений:

осадок орг. кислота
Дополнительно известно, что F – широко используемый в промышленности полимер.
ЗАДАЧА 2
Из 10 тонн руды, содержащей халькопирит (CuFeS2), получили 1,273 м3 98% -ной серной кислоты. Приняв суммарный выход по всем реакциям за 61,2%, плотность раствора серной кислоты за 1,8, рассчитайте содержание полезного минерала в руде. Остальная часть руды серы не содержит.
ЗАДАЧА 3
Теплота образования СО2 – 94 ккал/моль, жидкой воды – 68,3, парообразной воды – 57,8, метана ~0. Газовая конфорка бытовой плиты пропускает 10 мл метана в секунду. Условия на кухне – температура 200С, давление 750 мм. рт. ст. За какое время полностью выкипит чайник, содержащий 1 литр воды?
ЗАДАЧА 4
При сгорании 10гр. вещества А образовалось столько же литров СО2, сколько и при термическом разложении 69.228гр. щавелевой кислоты. Образовалось также такое количество воды, сколько необходимо для получения 5гр. вещества С из его неорганического производного вещества В. Известно, что реакция протекает по следующей схеме:
В + 2Н2О= С + Е.
Вещества А и С имеют одинаковый процентный состав, причем А в промышленности получают из С.
?1.Определить вещества А, С, Е и В.
?2. Написать уравнения разложения щавелевой кислоты и сгорания вещества А.
?3.Написать уравнение получения А из С, указать условия протекания реакции.
?4. Чьи имена носят реакции получения С из В и А из С?
?5. Как в промышленности получают С? Напишите уравнение реакции.
ЗАДАЧА 5
1,12 л (н.у.) газа А пропустили через 100 мл раствора, содержащего строго стехиометрическое количество соли Б, при этом выпал окрашенный осадок В (12,7 грамм) и выделился газ Д. В растворе осталось только вещество Е. Полученный раствор имеет сильную щелочную реакцию. Раствор вещества Е упарили, сухой остаток взвесили. Масса Е 5,6 грамм. Это количество Е снова растворили в воде. На титрование полученного раствора потребовалось 100мл 1 Н серной кислоты. Осадок В отделили и высушили. Он представляет собой темное твердое вещество, возгоняющееся при нагревании. В образует с крахмалом ярко-окрашенные комплексы. Вещества А и Д содержатся в природе, оба они являются сильными окислителями.
|
|
|
?1. Определите все вещества, ответ подтвердите расчетами. Напишите уравнение реакций.
?2. Где встречаются А и Д в природе? Укажите цвета А и Д в газообразном и жидком состояниях.
?3. Человечество до сих пор в значительных количествах получает вещество В из живой природы (т.е. из растений и организмов), предположите откуда добывается В? Какого цвета комплекс В с крахмалом?
?4. Определите молярную концентрацию соли Б в исходном растворе.
ЗАДАНИЯ РАЙОННЫХ ОЛИМПИАД ПО ХИМИИ
Республика Татарстан, 2006-2007 учебный год
Решения задач для 11 класса
ЗАДАЧА 1

Суммарный балл за задачу – 9 баллов: по 1 баллу за каждое неизвестное вещество.
ЗАДАЧА 2
Масса раствора серной кислоты 1,273 · 1,8 = 2,291 т
Масса чистой серной кислоты 2,291·0,98=2,245 т
Из 1 моль халькопирита (М = 183,5 г/моль) получается 2 моль серной кислоты (Посчитаем массу серной кислоты, которая может образоваться из 1 моль халькопирита: 2·98·61,2% = 119,95 г серной кислоты на 1 моль халькопирита). Для получения 2245000 грамм серной кислоты необходимо 2245000\119,95 = 18716 молей халькопирита. Таким образом, на производство серной кислоты ушло 18716* 183,5 = 3434000 грамм = 3,434 т чистого халькопирита. Содержание чистого халькопирита в руде = (3,434\10) * 100% = 34,34%.
Суммарный балл за задачу – 8 баллов: при условии приведения всех расчетов. 1 балл за массу раствора серной кислоты, 1 балл за массу чистой серной кислоты, 6 баллов по ситуации – за правильно составленные пропорции. Если приведены все формулы правильно, но неверный ответ (вычислительная ошибка), то за задачу 4 балла.
|
|
|
ЗАДАЧА 3
Теплота испарения воды – разность между теплотами образования жидкой и газообразной воды = 68,3 – 57,8 = 10,5 ккал/моль.
Метан сгорает:
CH4 + O2 = CO2 + 2H2O(газ)
Теплота реакции сгорания метана находится так: из суммы теплот образования продуктов реакции вычитается сумма теплот образования реагентов (везде учитываются коэффициенты в уравнении реакции). Теплота образования простых веществ (кислорода в нашем случае) равна нулю. Теплота образования метана также равна 0. Таким образом, теплота сгорания метана = 94 + 2*57,8 = 209,6 ккал/моль. Посчитаем, сколько метана выходит из конфорки за секунду. Согласно уравнению Менделеева-Клапейрона PV= nRT, где P,V и Т необходимо привести к Паскалям, литрам и Кельвинам соответственно:
P = 101325*750\760 = 99991 Па,
V = 10\1000 = 0,01 л
T = 273 + 20 = 293К
R = 8,31.
n = 4,21·10-4 моль метана.
Такое количество метана при сгорании дает = 4,21·10-4 * 209,6 = 0,0883 ккал. Для испарения литра воды (литр воды содержит 1000\18 = 55,6 моль воды) необходимо 583,8 ккал (=55,6 моль*10,5ккал\моль), учитывая, что в секунду выделяется 0,0883 ккал, необходимое количество теплоты получится за 583,8\0,0883 = 6612 сек. или 1 час 50 мин.
Суммарный балл за задачу – 8 баллов: при условии приведения всех расчетов. 1 балл за теплоту испарения воды, 1 балл за теплоту сгорания метана, 3 балла за правильное использование уравнения Менделеева-Клапейрона, 3 балла за правильный ответ. Если правильно приведены все формулы, но неверный ответ (вычислительная ошибка), то за задачу 4 балла.
ЗАДАЧА 4
А – бензол
С – ацетилен
Е – гидроксид кальция
В – карбид кальция.
Из уравнения разложения щавелевой кислоты:
НООС–СООН = СО2 + СО + Н2О находим кол-во образовавшегося углекислого газа(0.7692 моль). Пусть А - СхНу.
Из уравнения сгорания А: СхНу + (2х+у/2)О2=хСО2 + (у/2)Н2О
молярная масса А=10гр./0.7692моль·х=13х.. С другой стороны М(А)=12х+у.
откуда следует, что х=у. Веществом А может быть ацетилен или бензол.
Т.к. бензол в промышленности получают из ацетилена, то А – бензол, а С –
|
|
|
ацетилен.
2. НСОО–СООН =СО+ СО2 + Н2О
С6Н6 + 7.5О2 = 6СО2 +3Н2О
3. 3С2Н2 =С6Н6 (катализатор- Сакт, 400оС)
4. Реакция получения ацетилена- реакция Велера, реакция получения бензола - реакция Зелинского.
5. Ацетилен получают крекингом метана:
2СН4=С2Н2+3Н2
Суммарный балл за задачу – 10 баллов: по 1 баллу за каждое неизвестное вещество, по 1 баллу за каждое уравнение реакции, по 1 баллу за ответы на третий, четвертый (по 0,5 балла за каждую фамилию) и пятый вопросы.
ЗАДАЧА 5
Очевидно, В – йод. Его количество n(I2)= 12,7/254 = 0,05 моль
Определим Е. Скорее всего, Е – гидроксид щелочного металла
(растворимы в воде только щелочи и некоторые гидроксиды щелочноземельных металлов). Количество эквивалента серной кислоты
100 · 1/1000 = 0,1 моль. Если Е – гидроксид одновалентного металла, то
М(Е)= 5,6/0,1 = 56. Это гидроксид калия. Если Е – гидроксид двухвалентного металла, то подходящих вариантов нет.
Так как количества I2 и KOH соотносятся как 1:2, скорее всего, это иодид калия. Иод образуется в результате окисления окислителем А. Б не может быть солью кислородных кислот иода, т.к. в таком случае, невозможна реакция окисления газом А, в результате которой выделяется элементарный иод.
Из газообразных окислителей, содержащихся в природе, подходят только озон и кислород. Известна реакция окисления иодида калия озоном с выделением кислорода. Значит А – озон, Д – кислород.
 O3 + 2KI + H2O 2KOH + I2 + O2
O3 + 2KI + H2O 2KOH + I2 + O2
 2KOH + H2SO4 K2SO4 + H2O
2KOH + H2SO4 K2SO4 + H2O
2. Кислород и озон встречаются в атмосфере. Это бесцветные газы, жидкий кислород голубой, а жидкий озон – фиолетовый.
3. Иод добывается из некоторых водорослей. Он образует с крахмалом синий комплекс.
4. Количество иодида калия – 0,1 моль. Объем раствора – 100 мл, значит молярность раствора = 0,1·1000/100 = 1 М.
Суммарный балл за задачу – 15 баллов: по 2 балла за каждое неизвестное вещество, по 1 балла за каждое уравнение реакции, по 1 баллу за ответы на второй, третий и четвертый вопрос.








Класс 2010-2011 Район
Задача 1.
При прокаливании смеси гидроксида и карбоната цинка при 300°C получена смесь газов, плотность которой при этой температуре и давлении
1 атмосфера равна 0,62 г/л.
|
|
|
1. Напишите уравнения реакций, происходящих при прокаливании.
2. Вычислите массовую долю карбоната цинка в исходной смеси.
Задача 2.
Клей Назарова нашел широкое применение в оптической и авиационной промышленности. Он представляет собой полимер, получаемый по следующей схеме:
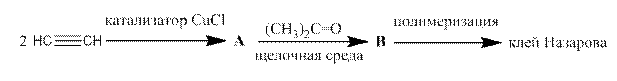
Вещество B – спирт. Структуру самого клея можно выразить следующей формулой (X, Y, R – некоторые заместители):

Нарисуйте структурные формулы веществ A и B, а также структуры заместителей X, Y и R.
Задача 3.
1. Напишите уравнения реакций и рассчитайте по приведенным данным стандартные энтальпии сгорания пропана и бутана.
2. Рассчитайте объем (н.у.) пропан-бутановой смеси, сжигание которой позволит нагреть 3 л воды от 5°С до 25°С, если известно, что смесь содержит 60 объемных процентов пропана, а образующийся в результате ее горения водяной пар не конденсируется. Теплоемкость жидкой воды в указанном интервале температур считать постоянной и равной 75,3 Дж/(К·моль). Примите, что всё выделяющееся при горении тепло идет исключительно на нагрев воды.
Стандартные энтальпии образования веществ из элементов:
Δ H °обр(C3H8 ) = –104,6 кДж/моль,
Δ H °обр(C4H10) = –126,1 кДж/моль,
Δ H °обр(CO2) = –393,5 кДж/моль,
Δ H °обр(H2Огаз) = –241,8 кДж/моль.
Задача 4.
При взаимодействии 1,4-дибромбутана с избытком бензола в присутствии катализатора образуются два основных органических продукта A и B. Если каждое из этих двух веществ подвергнуть последовательному воздействию одних и тех же реагентов (см. схему), конечными продуктами превращений будут вещества G и H. Вещество H имеет брутто-формулу С10Н8 и устойчиво к действию концентрированной серной кислоты, в то время как G под ее действием превращается в вещество I.

1. Напишите структурные формулы соединений A - I.
2. Почему соединение H, еще недавно широко использовавшееся в быту, сейчас не используется?
Задача 5.
Девочка нашла в шкафу бутылку с водным раствором перекиси водорода, на этикетке которой была указана концентрация – 60% по массе. Девочка решила уточнить ее концентрацию. Она отобрала m граммов раствора перекиси, прилила к ней разбавленный раствор серной кислоты, а затем добавляла по каплям раствор перманганата калия с концентрацией c моль KMnO4 в литре. После добавления V мл раствора появилось не исчезающее со временем фиолетовое окрашивание.
1. Напишите уравнение проведенной реакции. Выведите формулу для расчета массового содержания перекиси водорода по данным эксперимента.
|
|
|
2. Девочка получила следующий результат: при m = 0,60 г и c = 0,1 моль/л
V = 19,2 мл. Какова массовая доля перекиси водорода в растворе? Объясните этот результат.
Класс РЕШЕНИЯ
|
|
|


