 |
По 1 баллу за массу каждого вещества (всего 4 балла).
|
|
|
|
Всего максимум 8 баллов.
Задание 3
C
D
B
A
D
D
С
B
D
D
Балла за каждый верный ответ.
Всего максимум 15 баллов.
Задание 4
1. Наиболее быстро реагирует изомер 3 – трет-бутилбромид. (2 балла)
2. Для SN1 механизма предпочтителен изомер 3 (1 балл) – трет-бутилбромид, так как третичный карбокатион наиболее устойчив.
По механизму SN2 легче всего реагирует изомер 1 (1 балл) – 1-бромбутан, так как гидроксильной группе легче всего “подойти” к первичному атому углерода (наименьшие стерические затруднения).
3. Продукт с обращенной конфигурацией образуется в реакции по SN2 механизму (1 балл за верное отнесение, даже без объяснения), так как гидроксильная группа подходит с противоположной брому стороны и происходит обращение конфигурации:
R–Br + OH– ↔ [HO…R…Br]– ↔ HO–R + Br–
В случае SN1 механизма промежуточно образующийся карбокатион плоский, и гидроксил с равной вероятностью подходит с обеих сторон, поэтому получается рацемическая смесь.
4. Оптически активным является 2-бромбутан (1 балл за верный выбор изомера).


Исходное вещество Продукт
Балла за верную пару пространственных формул исходного вещества и продукта. Пара верна, если при замене в формуле исходного вещества брома на гидроксил и отражении в зеркале получается формула продукта. Могут быть приведены проекции Фишера и другие способы изображения пространственных изомеров.
Всего максимум 8 баллов.
Задание 5
Скорость расходования B не зависит от порядка или механизма реакции. Она зависит только от стехиометрических коэффициентов. Поэтому для всех трех случаев ответ одинаков: скорость расходования равна 3/2∙2 моль/(л∙c) =
3 моль/(л∙c) (По 2 балла, если получен такой ответ для каждого из пунктов а-в, всего 6 баллов)
|
|
|
Всего максимум 6 баллов.
Задание 6
Энергия связи равна энергии, необходимой для ее диссоциации. Так как в метане четыре связи C-H, то энергия разложения метана приближенно равна четырем энергиям связи C-H:
E(C-H) = 1656 кДж / 4 = 414 кДж/моль (3 балла)
В молекуле ацетилена две связи C-H и одна связь С≡С.
Значит, на тройную связь C≡C приходится энергия:
E(C≡C)= 1648 кДж – 2∙414 кДж = 820 кДж/моль (5 баллов)
Всего максимум 8 баллов.
Задание 7
1. Из всех перечисленных анионов катион серебра дает растворимое соединение только с нитратом, одно из веществ AgNO3. У бария и кальция из оставшихся анионов растворимы хлорид и гидроксид, но гидроксид кальция растворим хуже, чем бария, и он может выпадать при добавлении раствора гидроксида бария к раствору хлорида кальция, но не наоборот. Значит, еще 2 вещества – Ba(OH)2 и CaCl2. Тогда у цинка единственным возможным растворимым соединением является ZnSO4, а у аммония – (NH4)2CO3, поскольку силикат аммония не существует. В оставшейся пробирке находится Na2SiO3.
(По 1 баллу за каждую верную формулу, всего 6 баллов).
2. В азотной кислоте растворимы все карбонаты, гидроксид кальция и оксид серебра. Силикаты превращаются в кремниевую кислоту, которая нерастворима.
Ag2O + 2HNO3 = 2AgNO3 + H2O
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
ZnCO3 + 2HNO3 = Zn(NO3)2 + H2O + CO2
BaCO3 + 2HNO3 = Ba(NO3)2 + H2O + CO2
Ag2CO3 + 2HNO3 = 2AgNO3 + H2O + CO2
(0,5 балла за каждое верно указанное вещество, 0,5 балла за каждую верную реакцию, всего 6 баллов)
Всего максимум 12 баллов
Муниципальный этап всероссийской олимпиады школьников по химии
Класс
Время на выполнение заданий – 300 мин.
Максимально возможный балл - 57
Задание 1 – тест
В тетради нужно указать только номер вопроса и одну букву правильного варианта ответа. Объяснений писать не нужно. На каждый вопрос верен только один вариант ответа, если вы укажете два разных варианта, получите 0 баллов.
|
|
|
1. 1 моль брома при н.у.:
а) содержит 6,02 · 1023 атомов брома
б) имеет объем 22,4 л
в) имеет массу 160 г
г) существует в виде смеси 0,5 моль Br+ и 0,5 моль Br–
2. Ниже приведена зависимость между PV и T для одинаковых масс четырех газов W, X, Y и Z.

Какие это газы?
| W | X | Y | Z | |
| а | неон | кислород | CO2 | хлор |
| б | кислород | неон | хлор | CO2 |
| в | хлор | CO2 | кислород | неон |
| г | CO2 | хлор | неон | кислород |
3. Порошок для выпечки используется в кулинарии для изготовления более пышных пирогов. Что из себя представляет этот порошок?
а) FeCO3
б) NH4HCO3
в) NH4HS
г) кальцинированная сода
4. При нагревании Na2HAsO4 · nH2O масса уменьшилась на 40,42%. Какое число n молекул кристаллизационной воды входят в состав соединения?
а) 1 б) 3
в) 5 г) 6
д) 7
5. Водный раствор содержит равные концентрации слабой кислоты (HX), константа кислотности которой Ka = 2,9 · 10–5, и ее аниона (X–). Чему равен pH данного раствора?
а) 4,53 б) 5,53
в) 7,00 г) 8,47
д) 9,47
6. Обратный холодильник применяется для:
а) нагревания реакционной смеси
б) использования тепла, отведенного прямым холодильником
в) возврата паров веществ в реакционную смесь
г) оттаивания холодильников
7.

В данной реакции:
а) Пиридин – кислота, а ион пиридиния – сопряженное основание
б) H3O+ – кислота, а H2O – сопряженное основание
в) Пиридин – гетероцикл, а ион пиридиния – сопряженное основание
г) H3O+ – основание, а H2O – сопряженная кислота
8. Аденозинтрифосфат играет важную роль в биологических процессах.

Аденозинтрифосфат это:
а) аминокислота б) рибозы трифосфат
в) нуклеотид г) нуклеозид
9. Инициатором радикальной полимеризации может служить:
а) H2O б) H2O2
в) D2O г) HDO
10. Если химическая реакция является экзотермической, то всегда:
а) энергия активации больше, чем теплота реакции
б) энергия активации меньше нуля
в) энтальпия реакции больше нуля
г) продукты реакции имеют более низкую энергию, чем реагенты
11. Электронная конфигурация некоторого иона может быть представлена как 1s22s22p6. Номер периода, группы и заряд иона соответственно равны:
|
|
|
а) 3, 4, 4+ б) 3, 6, 2-
в) 3, 4, 2+ г) 2, 4, 4+
12. Какое из утверждений является неверным?
а) 1.00 ммоль глюкозы имеет массу 180 мг
б) 0.25 М раствор глюкозы образуется при растворении 45 г глюкозы в 1 дм3 воды
в) 90.0 г глюкозы содержат 18,066 · 1023 атомов углерода
г) 100 г 1 М раствора содержат 18,0 г глюкозы
13. Реакцией второго порядка не может быть:
а) окисление перманганатом калия б) радиоактивный распад
в) гидролиз трет-бутилхлорида г) гидрирование этилена
14. Синтез аммиака может быть представлен следующей реакцией:
N2 + 3H2 = 2NH3 Δ H = –92 кДж/моль
Что будет наблюдаться при повышении давления (сжатии реакционной смеси) без изменения ее температуры?
а) смещение равновесия влево
б) ускорение обратной реакции
в) ничего не изменится
г) прямая реакция станет эндотермической
15. Какой процесс является эндотермическим?
а) Растворение хлорида аммония в воде
б) Нейтрализация плавиковой кислоты основанием
в) Добавление воды к концентрированной серной кислоте
г) Сгорание металлического магния на воздухе с образованием оксида магния
Задание 2.
Напишите структурные формулы неизвестных веществ (обозначенных буквами A – G) в следующих органических реакциях:





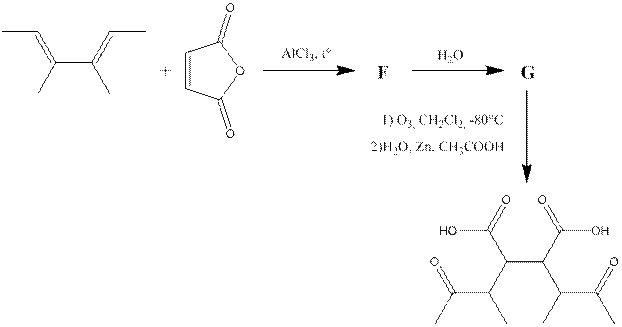
Задание 3.
Амедео Авогадро имел лабораторию на Венере, где атмосферное давление составляет 93 бар, ускорение свободного падения 8,87 м/с2, а комнатная температура равна 460°C.
1. Однажды он налил 1 моль цинка в колбу и пропустил над ним поток воды из баллона. Газ на выходе был очищен от примеси воды, а затем был измерен его объем. Чему он равен?
2. Когда в гости к Авогадро залетел Эванджелиста Торричелли, он показал свой знаменитый опыт, в котором столбик ртути поднимается по вертикально стоящей стеклянной трубке вслед за поршнем лишь до определенной высоты. Чему оказалась равна эта высота? Давление насыщенного пара ртути при 460°C 5 бар, плотность 12,6 г/см3.
3. По заказу Габера и Боша Авогадро изучал равновесие в реакции
N2 + 3H2 = 2NH3. Он поместил в герметичный сосуд с подвижным поршнем вместо крышки 1 моль азота и 3 моль водорода, через продолжительное время объем уменьшился в 1,84 раза. Определите, сколько моль аммиака содержится в сосуде. Чему равна константа равновесия процесса (при использовании для ее расчета давлений в барах)?
|
|
|
Считайте, что все газы ведут себя как идеальные. 1 бар = 1·105 Па.
Задание 4.
Юный химик Жженя нашел баночку с этикеткой «молибдата аммония тетрагидрат». Чтобы выяснить его количественный состав, он растворил
2,50 г данного вещества в избытке соляной кислоты в мерной колбе на
250 мл. Отобрав 50,0 мл полученного раствора, он поместил в него серебряную проволоку. После завершения реакции химик вынул проволоку и оттитровал раствор 0,1160 М раствором сульфата церия (IV). В процессе титрования молибден (V) окислился до молибдена (VI), а церий восстановился до Ce (III). На титрование пошло 24,4 мл раствора соли церия.
1. Определите концентрацию молибдена в моль/л в исходном растворе.
2. Определите с помощью расчетов формулу найденного вещества, если известно, что в его структуре катионов в 6 раз больше, чем анионов.
|
|
|


