 |
Задача 1. (Авторы – А.В. Герасимов, А.К. Гатиатулин)
|
|
|
|
Разложение аммиачной селитры при температуре ниже 270 °С протекает с образованием закиси азота (А) и воды (В) по следующему уравнению:
NH4NO3 = N2O + 2H2O (0,5 балла за уравнение реакции)
(A) (B)
Разложение аммиачной селитры при температуре выше 270 °С протекает с образованием азота (С), кислорода (D) и воды (В) по следующему уравнению:
2NH4NO3 = 2N2 + O2 + 4H2O (0,5 балла)
(C) (D) (B)
Закись азота (A) при нагревании взаимодействует с водородом с образованием азота (С) и воды (В).
N2O + H2 = N2 + H2O (0,3 балла)
(A) (C) (B)
Образование воды (В) происходит при прямом взаимодействии кислорода (D) и водорода.
2H2 + O2 = 2H2O (0,2 балла)
(D) (B)
При очень высоких температурах кислород (D) вступает в реакцию с азотом (С) с образованием оксида азота (II) (E), который окисляется кислородом при комнатной температуре с образованием оксида азота (IV) (F).
O2 + N2 = 2NO (0,2 балла)
(D) (C) (E)
2NO + O2 = 2NO2 (0,3 балла)
(E) (D) (F)
За формулы каждого из соединений A-F по 0,5 балла, всего 3 балла.
2. Существует 2 варианта протекания реакции разложения нитрата аммония:
NH4NO3 = N2O + 2H2O
2NH4NO3 = 2N2+ O2 + 4H2O
Реакция разложения нитрита аммония идет по уравнению:
NH4NO2 = N2 + 2H2O
Примем за х число молей нитрата. Поскольку в каждой реакции выделяется 2 моль воды, то суммарное число молей нитрата и нитрита составит 1,42/18/2 = 0,0394 моль. Таким образом, число молей нитрита (0,0394- х). Тогда для массы смеси верно уравнение:
80 х + 64·(0,0394- х) = 2,814
х = 0,0183 (моль).
Тогда масса нитрата аммония 0,0183 80 = 1,45 г, массовая доля 52%. Массовая доля нитрита 48%.
Балла за верный расчет значений массовых долей
3. Если нитрат аммония целиком разложился до закиси азота, то суммарное количество газов составит 0,0394 моль, V = 22,4·0,0394 = 0,88 л (1 балл). Если нитрат аммония целиком разложился до азота и кислорода, то суммарное число молей газов составит 0,0183 3/2 + (0,0394 – 0,0183) = 0,0485 моль, V = 1,1 л (1,5 балла).
|
|
|
Всего максимум 10 баллов
Задача 2. (Автор – Т.И. Магсумов)
1.
A 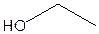
B 
C 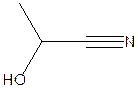
D 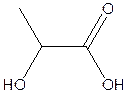
E 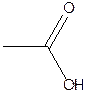
F 
G 
H 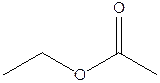
По 0,8 балла за каждую верную структуру, всего максимум 6,4 балла
2. 3C2H5OH + 2K2Cr2O7 + 8H2SO4 = 3CH3COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
СН3СНО + 2[Ag(NH3)2]OH = CH3COOH + 2Ag + 4NH3 + H2O
5CH3CH(OH)COOH + 4KMnO4 + 5H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 5CO2 + 11H2O
По 0,5 балла за верные исходные и конечные вещества в каждой реакции, по 0,5 балла за верные коэффициенты, всего максимум 3 балла
3.
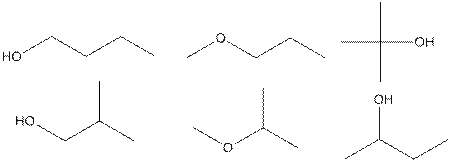
По 0,1 балла за каждый изомер, всего максимум 0,6 балла
Всего максимум 10 баллов
Задача 3. (Автор – Т.А. Мухаметзянов)
Поскольку правилами ограничен объем смеси, то наиболее выгодно использовать смесь, имеющую наибольшую энтальпию сгорания на единицу объема. Рассчитаем энтальпию сгорания одного литра каждой из трех смесей.
Смесь 1:
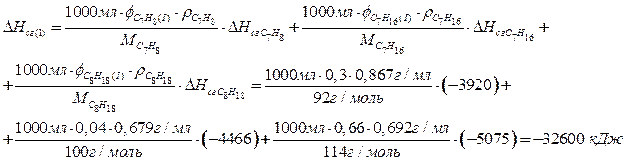
Смесь 2:
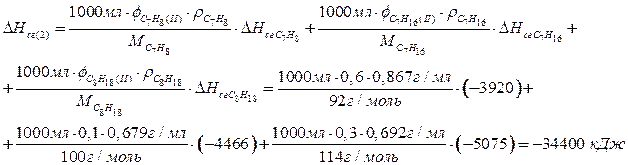
Смесь 3:
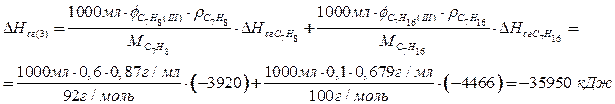
По 1,5 балла за верный расчет теплоты сгорания каждой из смесей, всего максимум 4,5 балла. Расчет может быть проведен для любого объема смесей (например, 150 л, 1 мл).
При сгорании 1 л смеси 3 (1,5 балла) выделяется наибольшее количество теплоты, поэтому ее использование более эффективно.
2. 95 (1 балл).
3. С7H8 + 9O2 = 7CO2 + 4H2O (1 балл)
С7Н16 + 11О2 = 7СО2 + 8Н2О (1 балл)
2С8Н18 + 25О2 = 16СО2 + 18Н2О (1 балл)
Всего максимум 10 баллов
Задача 4. (Автор – И.А. Седов)
1.  Кл (2 балла, если получено значение или выражение подставлено в конечную формулу).
Кл (2 балла, если получено значение или выражение подставлено в конечную формулу).
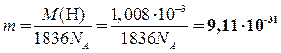 кг (2 балла, если получено значение или выражение подставлено в конечную формулу).
кг (2 балла, если получено значение или выражение подставлено в конечную формулу).
 Дж (4 балла).
Дж (4 балла).
2. 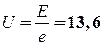 В (2 балла).
В (2 балла).
Всего максимум 10 баллов
Задача 5. (Автор – И.А. Седов)
1. MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2 (1 балл)
NaCl + AgNO3 = AgCl + NaNO3 (1 балл)
2. Так как при титровании исследуемого раствора нитратом серебра в реакции будут вступать оба хлорида, начать расчет следует с результатов титрования раствором ЭДТА.
|
|
|
Mg2+ + H2ЭДТА2– = [Mg(ЭДТА)] 2– + 2H+
ν(MgCl2) = ν(Mg2+) = ν(ЭДТА) = 0,0103М·0,0186л = 1,916·10-4 моль
c(MgCl2) = ν(MgCl2)·M(MgCl2) / V = 1,916·10-4·95,211/0,02 = 0,912 г/л (2,5 балла)
Найдем общее количество нитрата серебра, которое пошло на титрование:
ν (AgNO3) = 0,093·0,0232 = 2,158·10-3 моль.
Из этого количества на титрование вдвое меньшего, чем при титровании ЭДТА, количества хлорида магния ушло 2·1,916·10-4/2 = 1,916·10-4 моль AgNO3. Отсюда ν (NaCl) = 2,158·10-3 –1,916·10-4 =1,97·10-3 моль, c(NaCl) = 1,97·10-3·58,443/ 0,01 = 11,5 г/л (3 балла)
3.

(Вместо каждого O– могут быть отмечен карбонильный атом кислорода из той же карбоксильной группы)
(0,5 балла за отметку хотя бы 1 азота, 0,5 балла за отметку хотя бы 1 кислорода, 0,5 балла за отметку ровно 6 атомов, 0,5 балла, если все атомы отмечены верно, всего максимум 2 балла)
4. Более прочен комплекс с ЭДТА (0,5 балла). Окрашенный комплекс с индикатором образует только после того, как весь ЭДТА израсходуется.
Всего максимум 10 баллов
11 класс район 2013-2014
Задание 1
Сколько времени необходимо пропускать ток силой 4 А через раствор, содержащий ионы Cu2+, чтобы на катоде выделилось 2 г металлической меди?
Задание 2
65,25 г медного купороса CuSO4·5H2O растворили в воде. К этому раствору добавили 133 мл водного раствора KI с концентрацией 0,237 моль/л. Вычислите массы всех неорганических соединений, кроме воды, в полученной смеси.
Задание 3 – тест
В тетради нужно указать только номер вопроса и одну букву правильного варианта ответа. Объяснений писать не нужно. На каждый вопрос верен только один вариант ответа, если вы укажете два разных варианта, получите 0 баллов.
1. При увеличении концентрации одного из реагентов в три раза скорость реакции возросла в девять раз. Какой порядок реакции по отношению к этому веществу?
(A) нулевой (B) первый (C)второй (D) третий
2. Что является сопряженным основанием для 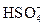 ?
?
(A) H+ (B) H2SO4 (C) OH- (D) 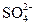
3. Какую гибридизацию имеет атом углерода в этилене С2H4?
(A) sp (B) sp2 (C) sp3 (D) s2p2
4. Кислород может быть получен термическим разложением всех приведенных соединений, кроме:
(A) оксида кальция (B) пероксида водорода
(C) оксида ртути(II) (D) озона
5. Число изомеров алкана, содержащего n атомов углерода, равно:
(A) 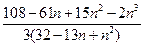
(B) 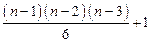
|
|
|
(C) Сумме чисел изомеров алканов с n -1 и n -2 атомами углерода (n >3)
(D) Ни одно из приведенных выше утверждений не верно
6. Какие величины равны в точке эквивалентности при титровании слабой одноосновной кислоты раствором гидроксида натрия?
(A) концентрации ионов H3O+ и OH-
(B) количество молей гидроксид-ионов в добавленном растворе гидроксида натрия и количество молей ионов гидроксония в изначальном растворе кислоты
(C) объем добавленного гидроксида натрия и объем первоначального раствора кислоты
(D) количество молей добавленного гидроксида натрия и изначальное количество молей кислоты
7. Какой термин соответствует заряду моля электронов?
(A) 1 Ампер (B) 1 Кулон
(C) 1 Фарадей (D) 1 Фарад
8. Сколько хиральных центров имеет данная молекула?
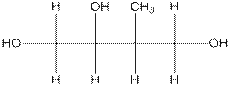
(A) 1 (B) 2 (C) 3 (D) 4
9. Какой из атомов может иметь в основном состоянии электрон с квантовыми числами n=3, l=2, ml=1, ms=-1/2?
(A) Na (B) Mg (C) P (D) Ti
10. Как записывается константа равновесия для следующей реакции?
2HgO(тв) = 2Hg(ж) + O2(г)
(A) K = [Hg][O2]/[HgO]
(B) K = [Hg]2[O2]/[HgO]2
(C) K = [Hg]2[O2]
(D) K = [O2]
Задание 4
Существует четыре структурных изомера с брутто-формулой C4H9Br. Структуры трех из них приведены ниже.
1) 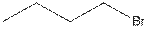 2)
2)  3)
3) 
Каждое из этих соединений может вступать в реакцию замещения с гидроксид-ионом с образованием спирта.
1. Какой из изомеров наиболее быстро реагирует с OH–?
Реакции замещения могут проходить либо по мономолекулярному (SN1), либо по бимолекулярному (SN2) механизму:
SN1: RBrà R+ + Br–; R+ + OH– à ROH
SN2: RBr + OH– à ROH + Br–
2. Какой из вышеприведенных алкилбромидов с наибольшей вероятностью реагирует по бимолекулярному механизму? Объясните свой выбор.
При замещении у хирального (асимметрического) атома углерода в случае одного из механизмов образуется продукт с обращенной конфигурацией, а в случае другого – рацемическая смесь.
3. Какой из этих случаев соответствует механизму SN1, а какой – SN2? Объясните свой выбор.
4. Для реакции с участием оптически активного изомера C4H9Br нарисуйте пространственные формулы исходного вещества и продукта замещения с обращением конфигурации.
|
|
|
Задание 5
В результате реакции, протекающей по уравнению:
2A + 3B à C
вещество A в некоторый момент времени расходуется со скоростью 2,0 моль/(л·с). Вычислите скорость расходования вещества B в тот же момент времени для трех случаев, когда скорость реакции выражается уравнением:
а) v = k [A]
б) v = k [A]2[B]
в) v = k [A]1/2[B]2
Задание 6
Исходя из теплот процессов:
CH4(г) = C(г) + 4H(г) – 1656 кДж
C2H2(г) = 2C(г) + 2H(г) – 1648 кДж,
вычислите энергию тройной связи C≡C. (г) обозначает молекулу или атом в газовой фазе.
Задание 7
На экспериментальном туре олимпиады по химии участникам было выдано 6 неподписанных пробирок, в каждой из которых находился бесцветный водный раствор некоторого неорганического вещества. Известно, что вещества могут содержать катионы Na+, NH4+, Ca2+, Ba2+, Zn2+, Ag+ и анионы OH–, CO32–, NO3–, SO42–, Cl–, SiO32–, при этом ни в каких двух пробирках нет одинаковых катионов или анионов. Оказалось, что при сливании растворов из любой пары пробирок выпадает осадок.
1. Определите, какое вещество находились в каждой из пробирок.
2. Какие из выпавших осадков полностью растворяются в разбавленной азотной кислоте? Напишите уравнения реакций.
Класс
Задание 1
Согласно закону Фарадея для электролиза
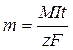 ,
,
где m – масса выделяющегося вещества,
M – молярная масса этого вещества,
I – сила тока,
t – время пропускания тока,
z – заряд иона,
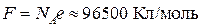 – постоянная Фарадея (заряд 1 моля электронов).
– постоянная Фарадея (заряд 1 моля электронов).
Отсюда:
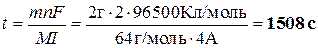 (5 баллов)
(5 баллов)
Всего максимум 5 баллов.
Задание 2
При добавлении KI к раствору сульфата меди происходит реакция:
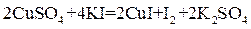 (2 балла)
(2 балла)
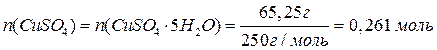
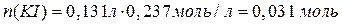
Следовательно, CuSO4 в избытке (2 балла за доказательство этого факта). Значит, количество продуктов реакции необходимо считать, исходя из количества KI.
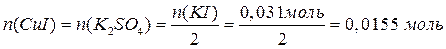
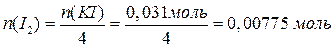
В результате взаимодействия с KI часть сульфата меди прореагировала, а другая часть – осталась:
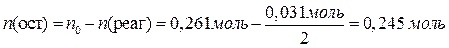
Теперь можно вычислить массы всех веществ в растворе:
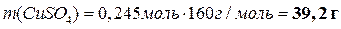

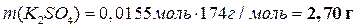
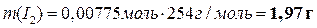
|
|
|


