 |
Гемомедиастинум. Внеплевральный разрыв внутренней грудной артерии
|
|
|
|

Рис.8 Стернотомия. Перевязка внутренней грудной артерии(стрелкой указаны проволочные лигатуры на грудине)

Рис. 9 Вариант дислокации желудка в плевральную полость
При разрыве левого купола диафрагмы

Рис. 10 На прямой проекции грудной клетки определяется дислокация тонкой кишки в плевральную полость при разрыве диафрагмы (уникальное наблюдение по объему перемещенных петель кишки, тень сердца не определяется; собственное наблюдение) 
Рис. 11 На боковой проекции определяется дислокация тонкой кишки в плевральную полость при разрыве диафрагмы (уникальное наблюдение по объему перемещенных петель тонкой кишки; собственное наблюдение)
У пострадавших с тяжелой сочетанной повреждениями живота и ЧМТ признаки повреждения органов брюшной полости могут отсутствовать или, наоборот, может наблюдаться симптоматика повреждения полого органа при отсутствии изменений в брюшной полости.Особенно трудной задачей является определение главной причины гипотонии.Вероятность повреждения органов брюшной полости у пострадавших с сочетанной травмой наиболее возрастает при ранениях грудной клетки и переломах таза.
Спутанность сознания (ЧМТ, алкогольное опьянение) характерна для сочетанной травмы, значительно затрудняет общение с пострадавшим и делает физикальное обследование недостоверным.
У пострадавших с закрытыми ранениями, требующих неотложной опера-ции следует быстро определить, какие диагностические исследования необхо-димо выполнить до неотложного оперативного вмешательства –торакотомии, лапаротомии, трепанации черепа и др., а какие, после операции. Закрытая трав-ма живота вызывает внутрибрюшное кровотечение значительно чаще, чем перитонит вследствие разрыва полых органов.
|
|
|
В связи с тем, что при сочетанных повреждениях живота в 23 % имелась доминирующая ЧМТ, адекватно интерпретировать данные исследования у этих пострадавших не всегда представлялось возможным.
Клинический опыт свидетельствует, что источники массивной кровопотери при закрытых повреждениях, необходимо выявлять прежде всего в брюшной или в плевральной полостях, области таза и бедренных костей. При исключении переломов бедренных костей и внутриплеврального кровотечения (рентгено-графия), наиболее вероятным источником кровотечения может быть брюшная полость или таз.
Анализ лечебно-диагностической тактики у 234 пострадавших с поврежде-ниями живота при сочетанной травме позволил разработать оптимальный лечебно-диагностический алгоритм (рис.12-cхема 1), приближенный к условиям практического здравоохранения.

Рис. 12 Схема -лечебно-диагностический алгоритм
С целью диагностики внутриплевральных и абдоминальных кровотечений ведущим методом диагностики является ультразвуковое исследование, которое выполняем при госпитализации у большинства пострадавших.
Учитывая высокую информативность и неинвазивность УЗИ, метод приме-няли у большинства пострадавших независимо от состояния пострадавших параллельно с реанимационными действиями.
Инструментальную диагностику торакоабдоминальных повреждений мы начинали с УЗИ в шоковом зале ОРИТ (в зависимости от степени тяжести состояния) или в условиях операционного отделения. При отсутствии убедительных данных за массивную кровопотерю (отсутствие разобщения париетального и висцеральных листков брюшины в пространстве Морисона, в спленоренальном промежутке и в отлогих местах брюшной полости) или обнаружение гемоперитонеума менее 300,0 мл проводили повторное УЗИ через 1-1,5 ч. За этот период, параллельно с интенсивной терапией, выполняли рентгенографические исследования черепа, грудной клетки, таза, проводили консультации (нейрохирург, уролог, травматолог, ангиохирург). Ценность УЗИ значительно снижается из-за подкожной эмфиземы и двигательном возбужде-нии пострадавших при поступлении. По нашим данным метод практически неинформативен при повреждении тонкой кишки. Поэтому при неубедительной информации мы исключали повторное УЗИ и выполняли дополнительные методы исследования (лапароцентез с ДПЛ или видеолапароскопия при отсутствии противопоказаний).
|
|
|
Обнаруженный при повторном УЗИ гемоперитонеум более 300 мл считали показанием к операции. Этот метод, обладая высокой чувствительностью при обнаружении жидкостных скоплений, может безопасно применяться с мини-мальным интервалом времени как при госпитализации, во время операции, так и после операции.
Отсутствие признаков гемоперитонеума при первичном УЗИ не является абсолютным признаком его отсутствия, так как только УЗИ-мониторинг при тяжелой сочетанной травме может исключить внутрибрюшное кровотечение. При обнаружении внутрипаренхиматозных гематом (печень, селезенка) и отсутствии гемоперитонеума применяли УЗИ-мониторинг с допплерографией, а если тяжесть состояния пострадавшего по APACHE II была менее 15 баллов, выполняли КТ. При увеличении в объеме внутрипеченочных гематом использо-вали ангиографию с эмболизацией, а нарастание гематомы селезенки считали показанием к операции.
Чувствительность УЗИ у пострадавших с сочетанной травмой живота (при выявлении гемоперитонеума) составила 81,2%, специфичность – 100%, точность – 75,2%.
У 92 пострадавших в связи с малоинформативным УЗИ был выполнен лапароцентез с перитонеальным диагностическим лаважом (ДПЛ).
Главной целью этого исследования является обнаружение свободной крови в брюшной полости. Содержание эритроцитов в эвакуированной жидкости из брюшной полости в количестве более 100 тыс. в 1 мм3 свидетельствует о поло-жительном лаваже, что является показанием к операции. Если в жидкости, по-лученной из живота содержание эритроцитов менее 50 000 в 1 мл, показано динамическое наблюдение за отделяемым по дренажу из брюшной полости.
|
|
|
Нами проведен анализ ДПЛ у 92 (20,6%) пострадавших с сочетанными ТАР. У 40 (43,5%) пострадавших ДПЛ был выполнен после УЗИ, в тех слу-чаях, когда результаты исследования не давали окончательного вывода о нали-чии свободной крови в животе и у 52 (56,5%) пострадавших с ЧМТ, у которых лапароскопия была противопоказана.
ДПЛ как основное исследование в диагностике внутрибрюшного крово-течения использован у 69 пострадавших. Показания к операции после ДПЛ были определены у 48 (69,6%) пострадавших. Из них у 12 (56,3%) в связи с ложно-позитивным результатом исследования были выполнены «нелечебные» лапаротомии, что привело в 12 наблюдениях к ухудшению состояния постра-давших с летальным исходом 9 пострадавших.
Одним из самых эффективных методов диагностики в хирургии повреж-дений по данным многих авторов считается ВТС. Ее диагностическая ценность при сочетанной травме живота по данным тех же авторов – 98-100%. Однако она абсолютно противопоказана у пострадавших в критическом состоянии, при нестабильной гемодинамике, при ЧМТ, тяжелой дыхательной недостаточности, при выраженном вздутии живота.
Нами проведен анализ результатов видеолапароскопических исследований у 127 (28,5% пострадавших с повреждениями живота при сочетанной травме. Из них у 53 (41,7%) лапароскопию проводили после УЗИ, а в 29 (37,8%) наблю- дениях – после лапароцентеза с ДПЛ. У 19 (15%) пострадавших неадекватная оценка данных лапароскопии (гемоперитонеум менее 300 мл крови при непродолжающемся кровотечении, поверхностные повреждения печени, брыжейки тонкой кишки, диапедез крови при переломе таза) послужила показанием к диагностической операции. 11 (8,7%) пострадавших после неоправданных диагностических лапаротомий умерли.
В большинстве наблюдений при обнаруженном гемоперитонеуме поиск источника неo проводили в связи с обнаруженными показаниями к операции (гемоперитонеум более 400-500 мл крови).
Основными показаниями для ДПЛ являются недостоверность физикаль-ных методов обследования вследствие ЧМТ и измененного уровня сознания, а также отсутствие возможности повторного обследования пострадавшего, кото-рому показано оперативное лечение по другой причине (торакотомия, кранио-томия и др.).
|
|
|
Следует отметить, что, несмотря на кардинальную роль ДПЛ в принятии решения оперировать пострадавшего или не оперировать, слабым местом этой методики является его гиперчувствительность, так как довольно нередко крово-течение останавливается самостоятельно без оперативного вмешательства. Лапаротомия (напрасная), выполненная после ложнопозитивного вывода о наличии крови в животе, опасна большим количеством послеоперационных осложнений, в виду того, что выполняется у пострадавших с сочетанной травмой при наличии экстраабдоминальных повреждений.
Главное предназначение ВЛС при тяжелой сочетанной травме живота в том, что она позволяет избежать напрасных лапаротомий. При лапароскопии имеется возможность определить морфологию травмы, количество крови, кишечного содержимого, степень повреждения печени, селезенки, имеется ли продолжающееся кровотечение и кроме того, диагностировать повреждение диафрагмы (только при наличии плеврального дренажа). У некоторых постра-давших (со стабильной гемодинамикой) лапароскопия оказывает лечебный эффект – проводится эвакуация свернувшегося гемоперитонеума, коагуляция поверхностных повреждений печени.
ТАКТИКА ЭТАПНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
ТОРАКОАБДОМИНАЛЬНЫХ ПОВРЕЖДЕНИЙ ПРИ СОЧЕТАННОЙ ТРАВМЕ
Проведенный анализ клинических наблюдений показал, что далеко не всегда, даже своевременная операция является спасительной.
В настоящее время проблема с выбором объема оперативного вмешате-льства у пострадавших с тяжелой сочетанной торакоабдоминальной травмой, на фоне травматического и геморрагического шока, по-прежнему остается не решенной.
Основными причинами летальных исходов при лечении закрытых соче-танных повреждений живота являются тяжесть состояния, трудности диагнос-тики, дополнительная интраоперационная кровопотеря, осложнения послеопе-рационного периода.
При поступлении пострадавших с сочетанными повреждениями груди и живота перед дежурными хирургами постоянно стоят неотложные вопросы по выбору тактики, очередности доступов и объему операции. Особенно трудными для решения этих проблем были случаи, когда встречались конкурирующие по тяжести торакальные и абдоминальные повреждения.
Несмотря на то, что в научной литературе на протяжении многих лет сооб-щается о значительном риске операций при шоке, подавляющее большинство хирургов, основываясь на личном опыте, продолжают использовать традицион-ную тактику радикального устранения всех повреждений органов грудной и брюшной полости независимо от тяжести состояния пострадавшего и прогноза исхода.
|
|
|
Анализ наших наблюдений показал, что дифференцированный подход к выбору оптимального хирургического объема у пострадавших с тяжелой сочетанной травмой при этапном лечении позволяет предупредить усугубление тяжести состояния и снизить послеоперационную летальность.
Опыт лечения пострадавших с сочетанными повреждениями живота, сопровождающихся массивной кровопотерей и шоком (1-я группа пострадавших), свидетельствует, что при выборе объема хирургической тактики следует учитывать данные интегральной оценки тяжести состояния и прогноза исхода при поступлении. В соответствии с данными интегральной оценки тяжести состояния и прогностического индекса была проведена стратификация пострадавших на группы.
Тяжесть состояния пострадавших, невыявленный приоритет продолжаю-щегося кровотечения, развивающаяся дыхательная недостаточность и признаки дислокации головного мозга диктуют принятие неотложных действий по спасе--нию пострадавших.Определяющая роль при этом принадлежит правильному выбору очередности и объему хирургического вмешательства с учетом объектив-ной оценки степени тяжести состояния и прогностического ИА.
В связи с тем, что степень кровопотери представляет собой один из самых значимых факторов, определяющих тяжесть травмы, определение величины кровопотери (относительно точное) можно получить с помощью индекса Allgower-Burri, 1967; «шоковый индекс»-Schockindex). Так, при индексе 0,5-0,8 можно предположить потерю крови, равную 500-750,0 мл; при индексе 1,0 потеря крови составляет 1500 мл; при индексе 1,2 – объем кровопотери равен 2000 мл; при индексе 1,5-2500 мл крови. Индекс Allgower-Burri допускает ошибку в сторону занижения истинной величины кровопотери на 15%.
В неотложных случаях для определения величины кровопотери (18) сле-дует ориентироваться на метод клинической оценки относительного соответ-ствия величины кровопотери по локализации сочетанной травмы: при тяжелой травме груди она составляет 2,5 литра; живота – до 2 л; переломе таза – 2 л; бедра – 1,5 л; голени – 0,8 л.
Тяжелая сочетанная торакоабдоминальная травма сопровождается выра-женной дыхательной недостаточностью, кровотечением в плевральную поло-сть, пневмотораксом, пневмогемотораксом, эмфиземой средостения, коллапсом или ателектазом легкого, повреждением магистральных сосудов, паренхиматозных и полых органов брюшной полости, нередко на фоне ЧМТ.
Выбор, очередность и объем хирургического вмешательства при соче-танных повреждениях определяется локализацией приоритетного кровоте-чения, простой и доступной объективной оценкой тяжести состояния и прогностического индекса исхода.
Пострадавшим 1-й группы (257) в неотложном порядке выполняли операции по поводу угрожающего жизни кровотечения в плевральную полость(ранения легких, бронхов, тотального гемоторакса напряженного пневмоторакса –торакотомия-58 (22,6%), массивного кровотечения в брюшную полость у 164 (63,8%) и у 35 (13,6%) пострадавших в забрюшинное пространство.
При наличии одновременно показаний к торакотомии и лапаротомии (5 пострадавших с массивным кровотечением в обе полости) операцию начинали с торакофренолапаротомии одним разрезом путем пересечения реберной дуги с целью быстрейшей одновременной остановки кровотечения в обеих полостях. У 4 пострадавших этот доступ был использован справа (разрыв печени, нижней полой вены, диафрагмы и нижней доли легкого, разрыв внутригрудной артерии) и у 1 пострадавшего слева (разрыв диафрагмы, селезенки, нижней доли легкого, левой почки, дислокация в плевральную полость желудка, тонкой кишки).
В других случаях, сочетанных ранениях груди и живота при наличии приоритета кровотечения в брюшной полости выполняют дренирование плевральной полости (220 -85,6% пострадавших), затем лапаротомию.
При наличии одновременно показаний к торакотомии (61-23,7% постра-давший) и декомпрессии головного мозга (23 -8,9%), вначале выполняли торакотомию.
В случаях сочетанной тяжелой ЧМТ, требующей неотложной декомпрес-сии головного мозга и внутрибрюшного кровотечения (11 пострадавших-4,2%) операции выполняли одновременно абдоминальные хирурги и нейрохирурги.
2-я группа (159 пострадавших-37,6%) объединила раненых, нуждающихся в срочной операции при повреждении паренхиматозных и полых органов брюшной полости без непосредственной угрозы для жизни кровотечения, повреждения диафрагмы, разрывы мочевого пузыря.
3-я группа – отсроченные операции (6 пострадавших)- не нарастающий гемоперитонеум (видеолапароскопия), свернувшийся гемоторакс (ВТС).
24 пострадавших с закрытыми повреждениями печени при сочетанной травме лечили консервативно.
Для каждой из групп была разработана хирургическая тактика, т.е. объем,
очередность и сроки оперативного вмешательства
Из 442 оперированных, у 257 (60,9%) были выполнены неотложные операции на органах брюшной полости и 503 экстраабдоминальных операций.
Нейрохирургические операции проведены 129 (30,6 %) пострадавшим (первичные хирургические обработки ран головы в анализ не включали). 11 пострадавшим (4,2%) с ЧМТ и внутрибрюшным кровотечением выполняли симультанные операции с нейрохирургами. Остальные (118) нейрохирургические операции проводили после окончания лапаротомии.
Дренирование плевральной полости в качестве неотложных мер,а также в превентивных целях перед интубацией трахеи выполнено у 220 (52,1%) пострадавших. По срочным показаниям плевральная полость дренирована у 112(26,5%) пострадавших.
Торакотомия по неотложным показаниям произведена у 61 (14,5%) пострадавшего и по срочным – у 26 (6,2%) пострадавших.
Правосторонняя переднебоковая торакотомия по неотложным показаниям произведена в 48 (55,2%) наблюдениях: при закрытых сочетанных повреждениях печени, диафрагмы, легкого, межреберных сосудов, а у 5 пост-радавших при закрытой торакоабдоминальной травме при большом гемотораксе и массивном внутрибрюшном кровотечении была выполнена торакофрено-лапаротомия одним разрезом с пересечением реберной дуги справа. Внутри-плевральное кровотечение было обусловлено разрывом диафрагмы и легкого, а внутрибрюшное – разрывами печени и ранением нижней полой вены. Левосто-ронняя переднебоковая торакотомия по неотложным и срочным показаниям произведена у 39 (44,8%) пострадавших.Следует отметить, что при сочетанных ТАР послеоперационные осложнения чаще всего наблюдались со стороны брюшной полости.
Повреждения селезенки были наиболее частой причиной внутрибрюшного кровотечения 36,6% (94 наблюдений), а разрывы печени у 76 (29,6%) постра-давших, которые явились поводом для неотложной операции.
Анализ данных интраоперационной кровопотери показал,что последняя возникает в результате: нарушений последовательности хирургических дейст-вий, когда преследуется главная задача операции – обнаружение и остановка кровотечения; рецидива профузного кровотечения из-за неадекватного осмотра забрюшинных гематом; отсутствия опыта у абдоминальных хирургов при пов-реждении сосудистых магистралей; некорректное использование марлевых там-понов в качестве временного гемостаза при профузных кровотечениях, так как нередко даже тугое тампонирование не обеспечивает остановку продолжаю-щего профузного кровотечения.
Традиционные П-образные и Z-образные швы без декомпрессии гепати-кохоледоха не всегда бывают достаточно эффективными в обеспечении герметизации ушитой раны печени.
Из 446 пострадавших с повреждениями живота при сочетанной травме в 24 наблюдениях в связи, с несоответствием клинической и ультразвуковой картины провели КТ-исследование у пострадавших с закрытой травмой печени. Средняя оценка тяжести состояния по шкале APACHE II 13±6,4 балла. Значительное преимущество КТ перед другими методами исследования – возможность оценивать степень повреждения печени в связи с современной тенденцией консервативного лечения некоторых повреждений, что особенно важно при сочетанной травме. Пострадавшим со стабильной гемодинамикой и спонтанном дыхании выполняли КТ при отсутствии показаний к неотложной операции при поступлении (данные УЗИ, рентгенографии) и через 24 часа повторяли КТ. Степень повреждения печени оценивали в соответствии с разработанной шкалой тяжести повреждения печени (тупая травма) S. Mirvis et al. (1989) по данным КТ-исследования (табл. 2).
Таблица 2
Шкала тяжести повреждения печени (тупая травма) по данным КТ
(S. Mirvis и соавт. 1989)
| Степень тяжести | Данные КТ |
| 1 ст. | Разрыв капсулы, поверхностные разрывы глубиной до 1 см; субкапсулярная гематома с максимальной толщиной до 1см; изолированные перипортальные кровоизлияния |
| 2ст. | Разрывы глубиной 1-3 см; центральные или субкапсулярные гематомы диаметром 1-3 см. |
| 3 ст. | Разрывы глубиной более 3см; центральные или субкапсулрные гематомы, диаметром более 3 см |
| 4 ст. | Массивная центральная или субкапсулярная гематома диаметром более 10 см; деструкция ткани или деваскуляризация в пределах одной доли |
Средний показатель степени повреждения печени у 24 (5,4%) пострадавших с симультанной травмой живота – 2. Выбор лечебной тактики зависел от результатов динамического КТ исследования. При этом учитывали показатели гемодинамики, отсутствие признаков активного внутрибрюшного и продолжающегося внутриплеврального кровотечения. В 19 наблюдениях пострадавших с гемоперитонеумом до 300 мл., обнаруженный при УЗИ и не нарастающий при КТ-исследовании оперативному не подвергали. К 10 суткам гемоперитонеум перестал выявляться. У 5 пострадавших гемоперитонеум при поступлении не определялся.
Таким образом, избранная консервативная тактика, на основании дина-мической КТ, позволила отказаться от напрасных лапаротомий у пострадав-ших с минимальными повреждениями печени (1-2 степень) при сочетанной травме в пользу более консервативного лечения.
Видеоторакоскопия (ВТС) была выполнена при свернувшемся левосто-роннем гемотораксе у 19 и у 8 пострадавших при правостороннем гемотораксе, у которых, при наличии сочетанной скелетной травмы можно было изменить горизонтальное положение на операционном столе. При этом следует отметить, что при ВТС у 4 пострадавших через сутки после поступления был выявлен разрыв правого купола диафрагмы.
В основе тактики лечения сочетанных повреждений лежит зависимость объема хирургического вмешательства от объективной оценки тяжести состоя-
ния (до, во время операции) и данных объективной оценки прогноза исхода.
Проспективные исследования и анализ наблюдений показали, что диффе-ренцированный подход при поступлении среди пострадавших с сочетанными повреждениями живота позволяет предупредить ухудшение состояния и умень-шить летальность. Выбор оптимального объема операции зависит от адекват-ной оценки характера повреждений, от степени тяжести состояния пострадав-шего и прогноза исхода.
Широко используемые в практике ОРИТ шкалы APACHE II и SAPS II, а также специально разработанные для травматологии шкалы TRISS – шкала оценки тяжести травмы, ISS не обладают достаточной чувствительностью для индии-видуального прогноза исхода при тяжелой сочетанной травме живота.
Их нельзя использовать для стратификации операционного риска не толь-ко из-за их громоздкости и необходимости оценки большого количества кли-нико-лабораторных параметров, но и по вполне объективным причинам – они не коррелируют с вероятностью летального исхода при закрытой абдомина-льной травме при поступлении (р=0,20 и р=0,756 соответственно), что не позволяет использовать их для выбора объема хирургического вмешательства.
Использование применяемого лечебно-диагностического алгоритма способ-ствовало снижению общей летальности среди пострадавших с повреждениями живота при сочетанной травме с 62,0% до 44,9%.
Анализ наблюдений свидетельствует, что и своевременно начатая операция не гарантирует благоприятный исход. По нашим данным, результат лечения во многом зависит от объема хирургической тактики (этапное хирургическое лечение или традиционная тактика). Ретроспективный анализ клинических наблюдений выявил, что в течение оперативного вмешательства отмечается значительное ухудшение состояния пострадавших (p < 0,001). Нарастание тяжести состояния наблюдается как в ходе остановки кровотечения (р < 0,001), так и во время радикального устранения повреждений (р < 0,05). При этом, полученные данные обнаружили наличие зависимости динамики нарастания тяжести состояния от дополнительной интраоперационной кровопотери и от объема операции.
В проспективном исследовании представлены результаты традиционного хирургического лечения и патогенетическое обоснование тактики этапной хирургической коррекции у пострадавших, доставленных в состоянии геморрагического шока с повреждениями живота при сочетанной травме.
Для оценки клинической эффективности разработанных тактических и технических приемов этапного хирургического лечения повреждений живота при сочетанной травме анализировали в исследуемых группах тяжесть состоя-ния при поступлении по APACHE II, ИА перед операцией, во время выполнения окончательного гемостаза, в конце операции и через сутки после операции, главные предикторы летального исхода, ИА, интраоперационную оценку органной дисфункции по шкале SOFA, оценку кожных покровов конечностей по визуально-аналоговой шкале и исход лечения.
41(48,9%) пострадавших с внутрибрюшным кровотечением транспортиро-ваны в операционную с минимальной продолжительностью диагностического этапа. В 43 (51,1%) наблюдениях диагностику повреждений живота при сочет-анной травме проводили в условиях ОРИТ.
Средняя продолжительность диагностических исследований составила 52,4±2,24 (20-165 минут); в операционной – 28,2±4,4 (12-58)минут; в условиях ОРИТ – 92,2 ±4,7 (64-148)минут.
Проведенные диагностические исследования в условиях операционной позволили сократить время между госпитализацией и началом операции.
В результате продолжительного диагностического этапа наступило ухудшение состояния у 29 (67,4%) пострадавших 2-й группы.
Прямая связь динамики тяжести состояния пострадавших во время операции с дополнительной интраоперационной кровопотерей привела к необходимости определения этой причины.
Установлено, что дополнительная интраоперационная кровопотеря возникает в результате несоблюдения очередности (последовательности) хирургического вмешательства.
В результате несоблюдения последовательности хирургических действий (вначале ушивание разрывов печени, резекции кишки и только после этого ушивание ранения вены) возникла дополнительная кровопотеря (более 1500,0мл), которая ухудшила тяжесть состояния. Следующей, по частоте причиной дополнительной интраоперационной кровопотери, является использование марлевых тампонов для временного гемостаза. Отсутствие профессиональных навыков и опыта в оказании помощи пострадавшим с повреждениями магистральных сосудов объясняет применение марлевых тампонов при профузных кровотечениях. По нашим данным, (из 29 ранений нижней полой вены в 12 наблюдениях произведено ушивание раны, а 17 случаях –перевязка сосудистой магистрали) даже компрессионное тампонирование магистрального сосуда не обеспечивает остановку продолжающегося кровотечения. Это объясняется тем, что марлевые салфетки или стандартные операционные пеленки закрывают поле зрения в зоне кровотечения, что не дает возможность избирательно клипировать или провести турникет вокруг поврежденной магистрали и в результате приводит к дополнительной кровопотере.
Интраоперационная кровопотеря усугубляется при ушивании трудно-ротируемых сегментов магистральных сосудов живота.Такими, (по нашим данным) наиболее часто повреждаемыми, трудноротируемыми сегментами магистральных сосудов живота являются нижняя полая вена (29 постра-давших), конфлюэнс общей подвздошной вены(12), воротная вена (6), верхнебрыжеечная артерия (под поджелудочной железой-4 пострадавших).
Большая вероятность развития необратимых изменений гомеостаза при сопутствующей интраоперационной кровопотере и хирургических манипу-ляциях у пострадавших с тяжелой сочетанной травмой живота стала главным аргументом для выполнения этапного хирургического лечения с выбранным адекватным объема операции.
Алгоритм этапного хирургического лечения представлен на рис. 13
 Рис. 13. Схематическое изображение алгоритма этапного хирургического лечения
Рис. 13. Схематическое изображение алгоритма этапного хирургического лечения
Таблица 3 Хирургические приемы при этапном хирургическом лечении у пострадавших 1-й группы (первичная операция)
| Локализация и характер повреждения | Кол- во постра- давших | Объем хирургического вмешательства при первичной операции | |
| Множественные повреждения печени, селезенки,диафрагмы, ободочной кишки, ге- моторакс,ЧМТ,перелом бедра | Прием Прингла,лигирование кровоточащих сосудов,тугая тампонада печени и ложа селезенки «потерянными тампонами (12), однорядный непрерыв-ный кишечный шов без формирования стомы, использование Тахокомба, лапаростомия,дренирование плевральной полости, скелетное вытяжение | ||
| Повреждения печени, нижней полой вены, 12п.к.,гемоторакс,ЧМТ, перелом таза, перелом голени | Перевязка нижней полой вены ниже почечных вен, тугая тампонада печени и забрюшинного пространства «потерянными тампонами (12), дренирование плевральной полости, скелетное вытяжение, лапаростомия (5 пострадавших); декомпрессивное ушивание лапаротомной раны (6) | ||
| Разрыв селезенки,диафрагмы, поджелудочной железы, тонкой кишки, подвздошных сосудов,гемоторакс,ЧМТ,перелом таза | Дренирование плевральной полости,ушивание ран сосудов,спленэктомия,тугая тампонада ложа селезенки и дренирование зоны поджелудочной железы двухпросветными дренажами, однорядный непрерывный кишечный шов,узловые швы на диафрагму,лапаростомия (10) и декомпрессивное ушивание лапаротомной раны (5);, дренирование брюшной полости | ||
| Разрывы печени,, верхней брыжеечной артерии,некроз тонкой кишки, ЧМТ,перелом таза | Прием Прингла, пальцевой гемостаз сосудистой магистрали, сосудистый шов (5), перевязка артерии (2),спленэктомия,тугая тампонада «потерянными тампонами», резекция кишки без формирования анастомоза, лапаростомия (7),дренирование брюшной полости | ||
| Всего |
Приемы и методы хирургического лечения при этапном лечении представлены в табл. 3
Основным техническим приемом во время первичной операции у пострадав-ших 1-й группы (после временной остановки кровотечения из магистрального сосуда) была компрессионная тампонада с целью форсированной остановки кровотечения, тем самым предотвращая дополнительную интраоперационную кровопотерю. Необходимость применения тугой тампонады у пострадавших с повреждениями живота при сочетанной травме была связана с диффузным кровотечением из различных источников: обширные повреждения печени, поджелудочной железы, забрюшинная гематома, обширные повреждения кишки или сочетания этих источников кровотечения.
Область массивных диффузных кровотечений туго тампонировали «поте-рянными» марлевыми салфетками в 6 слоев (10х100см), пеленками, полотен-цами в количестве необходимом и достаточном для создания тугой тампонады с условием обеспечения адекватного венозного возврата (рис.14). Для контроля гемостаза к области тампонирования подводили дренажную трубку.
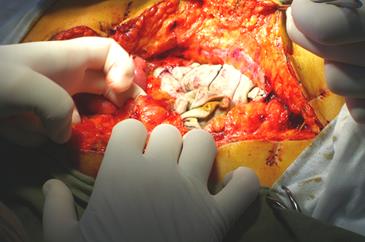
Рис. 14 Тампонада забрюшинного пространства полотенцем
С целью адекватной компрессии источников кровотечения при обширных повреждениях печени использовали 8-9 марлевых салфеток, для тампонирова-ния забрюшинных источников кровотечения до 8, а при сочетании повреждений – до 12 марлевых салфеток, пеленок, полотенца (рис.14).
Методику отсроченного анастомозирования (резекцию кишки при массив-ных повреждениях без первичного анастомозирования) комбинировали с комп-рессионной тампонадой раневых поверхностей печени и забрюшинного прост-ранства, поджелудочной железы в 27(65,9%) наблюдениях.

Рис. 15 Удаление «потерянного» полотенца
Установлено, что тяжесть состояния пострадавших к моменту начала осно-вного этапа операции у пострадавших основной и контрольной групп не имела значимых различий. Однако, следует отметить, в этот период интраоперацион-ная кровопотеря у пострадавших 2-й группы (традиционная тактика) была дос-товерно выше: 1300 (600-2100 мл) против 810 (710-910 мл) в 1-й группе (р < 0,001). Это объясняется применением разработанных технических приемов (1-й группа) и форсированной остановки кровотечения при ранении магистраль-ных сосудов,а также уменьшением кровотечения путем тугой тампонады раневых поверхностей паренхиматозных органов и забрюшинного простра-нства. Характер повреждений и объем повторной программной операции у пострадавших 1-й группы представлен в табл. 4
Таблица 4 Данные об объеме оперативного вмешательства на повторной
|
|
|


